دوره 22، شماره 1 - ( بهار 1400 )
دوره، شماره، فصل و سال، شماره مسلسل |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Poursaeed F, Tahan N, Dehghan Manshadi F, Akbarzade Bagheban A R. Effects of Extracorporeal Shockwave Therapy on Clinical and Neurophysiological Indices of Spasticity Inpatients With Upper Motor Neuron Lesions: A Systematic Review and Meta-analysis. jrehab 2021; 22 (1) :28-47
URL: http://rehabilitationj.uswr.ac.ir/article-1-2836-fa.html
URL: http://rehabilitationj.uswr.ac.ir/article-1-2836-fa.html
پورسعید فرشته، طحان ناهید، دهقان منشادی فریده، اکبرزاده باغبان علیرضا. تأثیر شاکویودرمانی بر شاخصهای بالینی و نوروفیزیولوژیک اسپاستیسیتی در بیماران دارای آسیب نورون محرکه فوقانی (مرور سیستماتیک و متاآنالیز). مجله توانبخشی. 1400; 22 (1) :28-47
URL: http://rehabilitationj.uswr.ac.ir/article-1-2836-fa.html
1- گروه فیزیوتراپی، دانشکده مطالعات حرفهای، دانشگاه نورث ایسترن، بوستن، ماساچوست، ایالات متحده امریکا.
2- گروه فیزیوتراپی، دانشکده علوم توانبخشی، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران. ،nahidta2431@gmail.com
3- گروه فیزیوتراپی، دانشکده علوم توانبخشی، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران.
4- گروه آمار زیستی، مرکز تحقیقات پروتئومیکس، دانشکده پیراپزشکی، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران.
2- گروه فیزیوتراپی، دانشکده علوم توانبخشی، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران. ،
3- گروه فیزیوتراپی، دانشکده علوم توانبخشی، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران.
4- گروه آمار زیستی، مرکز تحقیقات پروتئومیکس، دانشکده پیراپزشکی، دانشگاه علوم پزشکی شهید بهشتی، تهران، ایران.
متن کامل [PDF 7057 kb]
(1729 دریافت)
| چکیده (HTML) (5051 مشاهده)
متن کامل: (2913 مشاهده)
مقدمه
اسپاستیسیتی یکی از نشانههای آسیب نورون محرکه فوقانی است که به طور معمول پس از یک دوره شلی عضلانی به صورت افزایش مقاومت وابسته به سرعت در حین حرکت پاسیو به همراه تشدید رفلکسهای تاندونی ظاهر میشود [1]. این اختلال حرکتی به طور شایع در بیماران فلج مغزی [2]، فلج نیمه بدن [3]، مولتیپل اسکلروز [4] و آسیبهای نخاعی [5] مشاهده میشود. مکانیسمهای عصبی و غیرعصبی میتوانند منجر به افزایش مقاومت در برابر حرکت پاسیو در آسیب نورون محرکه فوقانی شود. مکانیسمهای عصبی به واسطه برداشته شدن مهار مسیرهرمی کورتیکو اسپینال و مسیرهای خارج هرمی (روبرواسپینال و وستیبولواسپینال) از روی ساقه مغز و نخاع است [6]، اما مکانیسمهای غیرعصبی، در ارتباط با سفتی عضلانی و به واسطه مقادیر بالای کلاژن و بافت همبند در عضله اسپاستیک است [2]. اسپاستیسیتی طولانیمدت میتواند سبب تغییر در خواص ساختاری عضله درگیر و عضلات مجاور به صورت کوتاهی یا فیبروز عضلات شود که سبب کنترل غیر طبیعی موقعیت اندام و در نتیجه اختلال حرکتی در اندام میشود [7].
دارودرمانی و مداخلات توانبخشی بهخصوص روشهایی که تمرکز بر انعطاف بافت همبند دارند، از روشهای درمانی غیرتهاجمی برای کاهش اسپاستیسیتی به شمار میروند [8]. امروزه یکی از روشهای امیدبخش برای کاهش اسپاستیسیته شوکویودرمانی است، اما هنوز به عنوان یک درمان رایج مورد استفاده قرار نگرفته است [9، 10]. شاکویو شامل امواج صوتی با میزان انرژی بالاست (100 مگاپاسکال) که در مدت زمان بسیار کوتاه (10 میکروثانیه) و با فشار سریع تولید میشود [11]. استفاده از شاکویو دردرمان ضایعات ارتوپدی از قبیل عدم جوشخوردگی در استخوانهای بلند، التهاب فاشیای کف پا، تاندونیت کلسیفیه شانه، بیماریهای التهابی تاندون و اسپاستیسیته گزارش شده است [12]. شاکویودرمانی میتواند به دو شکل فوکال و رادیال استفاده شود. امواج شاکویو فوکال از طریق الکترومغناطیس، هیدروالکتریک و پیزوالکتریک تولید میشود، در حالی که امواج شاکویو رادیال به طریق پنوماتیک ایجاد میشود، علاوه بر آن عمق نفوذ شاکویو رادیال کمتر از شاکویو فوکال است [11].
تاکنون مکانیسم دقیقی برای توجیه اثرات شاکویودرمانی در کاهش اسپاستیسیتی ارائه نشده است. گروهی از مطالعات نتیجه گرفتهاند که امواج ضربهای شاکویو میتواند تأثیر مستقیمی بر روی عضلات فیبروز و اجزای غیررفلکسی عضله اسپاستیک داشته باشد این مکانیسم اثر شاکویو، با توجه به نتایجی که برخی از مطالعات درباره اثرات مثبت شاکویودرمانی در مشکلات تاندونی و اسکلتی عضلانی بیماران با عضله هیپر تون ارائه دادهاند، قابل توجیه است [13]. مطالعاتی وجود دارد که بیان میکند شاکویو در سطح عضله قادر به تغییر در جریان حسی عضله است که با اثر بر روی پایانههای آزاد عصبی منجر به کاهش تحریکپذیری عضله در سطح نخاع و درنهایت سبب کاهش اسپاستیسیته میشود [14]. مطالعه روی نمونههای غیرانسانی نشان میدهد که شاکویو انتقال عصبی عضلانی در پیوندگاه عصبی عضلانی رابه تأخیر میاندازد و به عنوان مکانیسمی احتمالی در کاهش درد و تونیسیته عضلات مطرح است [15].
ابزارهای بالینی و روشهای نوروفیزیولوژیک مختلفی برای ارزیابی اسپاستیسیتی وجود دارد. ارزیابی پاسخهای نوروفیزیولوژیکی عضله اسپاستیک با بررسی رفلکس تاندونی، موج F، موج M و رفلکس هافمن امکانپذیر است [16، 17]. مقیاس آشورت ابزاری شایع جهت ارزیابی بالینی اسپاستیسیتی است که بر پایه ارزیابی مقاومت به حرکت پاسیو مفاصل طراحی شده است [18]. بیشتر مطالعات انجامشده در زمینه اثرات شاکویودرمانی بر تون عضلانی از مقیاس بالینی آشورت یا مقیاسهای بیومکانیک استفاده کردهاند و تنها در دو مطالعه ارزیابی با اندازهگیری شاخصهای معماری عضله توسط سونوگرافی انجام شده است [19, 20].
با توجه به ضرورت درمان اسپاستیسیتی در بیماران نورولوژی و با توجه به این نکته که مطالعات بالینی انجام شده در زمینه اثر شاکویودرمانی برکاهش تون عضله اسپاستیک فاقد پروتکل درمانی مشخصی میباشند و از آنجایی که مرور سیستماتیک و متا آنالیز ابزاری برای خلاصه کردن مدارک و شواهد موجود به صورت دقیق و قابل اطمینان است [21]. هدف از مطالعه حاضر تجزیه و تحلیل مطالعات کار آزمایی بالینی در دسترس در ارتباط با میزان اثر بخشی شاکویودرمانی در کاهش تون عضله اسپاستیک درزمانهای بلافاصله و سه ماه پس از اعمال شاکویو در بیماران ضایعه نورون محرکه فوقانی میباشد.
روش بررسی
در این مطالعه بانکهای اطلاعاتی شامل ساینس دایرکت، مدلاین، وب آو ساینس و اسکوپوس و موتور جستوجوی گوگل اسکالر با استفاده از کلمات کلیدی هیپرتونیسیتی عضلانی یا اسپاستیسیتی، فلج مغزی، سکته مغزی، مولتیپل اسکلروز، شاکویودرمانی جستوجو شدند. کلیه مطالعات کارآزمایی بالینی از ژانویه 2005 تا ژانویه 2020 وارد مطالعه شدند. مطالعاتی که اسپاستیسیتی را با مقیاس اصلاحشده آشورت و یا شاخصهای نوروفیزیولوژیک در بیماران سکته مغزی، فلج مغزی و مولتیپل اسکلروز بررسی کردند انتخاب شدند. از کلمات کلیدی هیپرتونیسیتی عضلانی یا اسپاستیسیتی، فلج مغزی، سکته مغزی، مولتیپل اسکلروز و شاکویودرمانی برای جستوجو استفاده شد. جستوجو و بررسی مطالعات واجد شرایط از نظر معیارهای ورود و ارزیابی کیفیت متدولوژیک مطالعات انتخابشده توسط دو محقق مستقل انجام شد.
در ابتدا خلاصه مقالات بررسی شد، سپس بر اساس معیارهای ورود به مطالعه متن کامل مقالات مورد بررسی قرار گرفت. مطالعاتی که امکان دسترسی به متن کامل نداشت، به زبانی غیرانگلیسی چاپ شده بودند و از شاکویو برای اهدافی غیر از درمان اسپاستیسیتی استفاده کرده بودند از مطالعه حذف شدند. مقالات با این ویژگیها برای انجام متاآنالیز انتخاب شدند: 1. مقاله اصیل پژوهشی؛ 2. مطالعاتی که به صورت کارآزمایی بالینی با گروه کنترل یا پیش آزمونـ پسآزمون طراحی شده بود؛ 3. مطالعاتی که از مقیاس آشورت برای ارزیابی اسپاستیسیتی (حداقل در دو زمان، یکی بلافاصله پس از مداخله و دیگری سه ماه پس از شاکویوتراپی استفاده کرده بود؛ 4. مطالعاتی که از شاخصهای نوروفیزیولوژیکی جهت ارزیابی اسپاستیسیتی استفاده کرده بود. کیفیت متدولوژیک مطالعات انتخابی با استفاده از مقیاس داون و بلک ارزیابی شد. این مقیاس شامل 27 آیتم است و برای ارزیابی کیفیت متدولوژیک مطالعات تصادفی و غیرتصادفی طراحی شده است [22].
آنالیز آماری
تفاوت میانگینها به عنوان اندازه اثر در نمرات مقیاس آشورت مفصل قبل، و بلافاصله بعد از مداخله و سه ماه پس از مداخله برای انجام متاآنالیز در نظر گرفته شد. همچنین فراتحلیل دیگری روی تفاوت میانگینها در شاخصهای نورو فیزیولوژیکی قبل و بعد از مداخله انجام شد. بررسی هتروژنیسیتی (وجود یا عدم وجود همگنی) بین مطالعات با استفاده از شاخصI2 انجام شد. با توجه به تأیید ناهمگنی مطالعات (I2>%50) در تحلیل مقیاس آشورت و شاخصهای نورو فیزیولوژیکی از مدل اثرات تصادفی برای انجام متاآنالیز استفاده شد. این مدل مقدار تفاوت میانگین هر مطالعه و مقدار تفاوت میانگین ترکیبشده و همچنین فواصل اطمینان آنها را نشان میدهد. سوگیری انتشار نیز به کمک آزمون ایگر بررسی شد. دادهها با استفاده از نرمافزار STATA نسخه 11 آنالیز شدند. مقادیر P کمتر از 0/05 به عنوان مقادیر معنیدار از نظر آماری در نظر گرفته شدند.
یافتهها
با استفاده از کلمات کلیدی مذکور، درمجموع 98 مقاله در مرحله اول انتخاب یافت شد که پس از حذف 31 مقاله غیرمرتبط و 43 مقاله تکراری 24 مقاله باقی ماند. از بین این مقالات متن کامل دو مقاله یافت نشد و سه مقاله نیز کارآزمایی بالینی بر روی حیوانات بود. پنج مقاله دیگر به دلایل زیر حذف شدند: سه مطالعه مقادیر میانگین و انحراف معیار را گزارش نکرده بودند و دو مقاله از مقیاس اصلاحشده آشورت استفاده کرده بودند. در مجموع چهارده مقاله وارد بررسی سیستماتیک و متاآنالیز شدند. فلوچارت بررسی مطالعات در تصویر شماره 1 نشان داده شده است.
اسپاستیسیتی یکی از نشانههای آسیب نورون محرکه فوقانی است که به طور معمول پس از یک دوره شلی عضلانی به صورت افزایش مقاومت وابسته به سرعت در حین حرکت پاسیو به همراه تشدید رفلکسهای تاندونی ظاهر میشود [1]. این اختلال حرکتی به طور شایع در بیماران فلج مغزی [2]، فلج نیمه بدن [3]، مولتیپل اسکلروز [4] و آسیبهای نخاعی [5] مشاهده میشود. مکانیسمهای عصبی و غیرعصبی میتوانند منجر به افزایش مقاومت در برابر حرکت پاسیو در آسیب نورون محرکه فوقانی شود. مکانیسمهای عصبی به واسطه برداشته شدن مهار مسیرهرمی کورتیکو اسپینال و مسیرهای خارج هرمی (روبرواسپینال و وستیبولواسپینال) از روی ساقه مغز و نخاع است [6]، اما مکانیسمهای غیرعصبی، در ارتباط با سفتی عضلانی و به واسطه مقادیر بالای کلاژن و بافت همبند در عضله اسپاستیک است [2]. اسپاستیسیتی طولانیمدت میتواند سبب تغییر در خواص ساختاری عضله درگیر و عضلات مجاور به صورت کوتاهی یا فیبروز عضلات شود که سبب کنترل غیر طبیعی موقعیت اندام و در نتیجه اختلال حرکتی در اندام میشود [7].
دارودرمانی و مداخلات توانبخشی بهخصوص روشهایی که تمرکز بر انعطاف بافت همبند دارند، از روشهای درمانی غیرتهاجمی برای کاهش اسپاستیسیتی به شمار میروند [8]. امروزه یکی از روشهای امیدبخش برای کاهش اسپاستیسیته شوکویودرمانی است، اما هنوز به عنوان یک درمان رایج مورد استفاده قرار نگرفته است [9، 10]. شاکویو شامل امواج صوتی با میزان انرژی بالاست (100 مگاپاسکال) که در مدت زمان بسیار کوتاه (10 میکروثانیه) و با فشار سریع تولید میشود [11]. استفاده از شاکویو دردرمان ضایعات ارتوپدی از قبیل عدم جوشخوردگی در استخوانهای بلند، التهاب فاشیای کف پا، تاندونیت کلسیفیه شانه، بیماریهای التهابی تاندون و اسپاستیسیته گزارش شده است [12]. شاکویودرمانی میتواند به دو شکل فوکال و رادیال استفاده شود. امواج شاکویو فوکال از طریق الکترومغناطیس، هیدروالکتریک و پیزوالکتریک تولید میشود، در حالی که امواج شاکویو رادیال به طریق پنوماتیک ایجاد میشود، علاوه بر آن عمق نفوذ شاکویو رادیال کمتر از شاکویو فوکال است [11].
تاکنون مکانیسم دقیقی برای توجیه اثرات شاکویودرمانی در کاهش اسپاستیسیتی ارائه نشده است. گروهی از مطالعات نتیجه گرفتهاند که امواج ضربهای شاکویو میتواند تأثیر مستقیمی بر روی عضلات فیبروز و اجزای غیررفلکسی عضله اسپاستیک داشته باشد این مکانیسم اثر شاکویو، با توجه به نتایجی که برخی از مطالعات درباره اثرات مثبت شاکویودرمانی در مشکلات تاندونی و اسکلتی عضلانی بیماران با عضله هیپر تون ارائه دادهاند، قابل توجیه است [13]. مطالعاتی وجود دارد که بیان میکند شاکویو در سطح عضله قادر به تغییر در جریان حسی عضله است که با اثر بر روی پایانههای آزاد عصبی منجر به کاهش تحریکپذیری عضله در سطح نخاع و درنهایت سبب کاهش اسپاستیسیته میشود [14]. مطالعه روی نمونههای غیرانسانی نشان میدهد که شاکویو انتقال عصبی عضلانی در پیوندگاه عصبی عضلانی رابه تأخیر میاندازد و به عنوان مکانیسمی احتمالی در کاهش درد و تونیسیته عضلات مطرح است [15].
ابزارهای بالینی و روشهای نوروفیزیولوژیک مختلفی برای ارزیابی اسپاستیسیتی وجود دارد. ارزیابی پاسخهای نوروفیزیولوژیکی عضله اسپاستیک با بررسی رفلکس تاندونی، موج F، موج M و رفلکس هافمن امکانپذیر است [16، 17]. مقیاس آشورت ابزاری شایع جهت ارزیابی بالینی اسپاستیسیتی است که بر پایه ارزیابی مقاومت به حرکت پاسیو مفاصل طراحی شده است [18]. بیشتر مطالعات انجامشده در زمینه اثرات شاکویودرمانی بر تون عضلانی از مقیاس بالینی آشورت یا مقیاسهای بیومکانیک استفاده کردهاند و تنها در دو مطالعه ارزیابی با اندازهگیری شاخصهای معماری عضله توسط سونوگرافی انجام شده است [19, 20].
با توجه به ضرورت درمان اسپاستیسیتی در بیماران نورولوژی و با توجه به این نکته که مطالعات بالینی انجام شده در زمینه اثر شاکویودرمانی برکاهش تون عضله اسپاستیک فاقد پروتکل درمانی مشخصی میباشند و از آنجایی که مرور سیستماتیک و متا آنالیز ابزاری برای خلاصه کردن مدارک و شواهد موجود به صورت دقیق و قابل اطمینان است [21]. هدف از مطالعه حاضر تجزیه و تحلیل مطالعات کار آزمایی بالینی در دسترس در ارتباط با میزان اثر بخشی شاکویودرمانی در کاهش تون عضله اسپاستیک درزمانهای بلافاصله و سه ماه پس از اعمال شاکویو در بیماران ضایعه نورون محرکه فوقانی میباشد.
روش بررسی
در این مطالعه بانکهای اطلاعاتی شامل ساینس دایرکت، مدلاین، وب آو ساینس و اسکوپوس و موتور جستوجوی گوگل اسکالر با استفاده از کلمات کلیدی هیپرتونیسیتی عضلانی یا اسپاستیسیتی، فلج مغزی، سکته مغزی، مولتیپل اسکلروز، شاکویودرمانی جستوجو شدند. کلیه مطالعات کارآزمایی بالینی از ژانویه 2005 تا ژانویه 2020 وارد مطالعه شدند. مطالعاتی که اسپاستیسیتی را با مقیاس اصلاحشده آشورت و یا شاخصهای نوروفیزیولوژیک در بیماران سکته مغزی، فلج مغزی و مولتیپل اسکلروز بررسی کردند انتخاب شدند. از کلمات کلیدی هیپرتونیسیتی عضلانی یا اسپاستیسیتی، فلج مغزی، سکته مغزی، مولتیپل اسکلروز و شاکویودرمانی برای جستوجو استفاده شد. جستوجو و بررسی مطالعات واجد شرایط از نظر معیارهای ورود و ارزیابی کیفیت متدولوژیک مطالعات انتخابشده توسط دو محقق مستقل انجام شد.
در ابتدا خلاصه مقالات بررسی شد، سپس بر اساس معیارهای ورود به مطالعه متن کامل مقالات مورد بررسی قرار گرفت. مطالعاتی که امکان دسترسی به متن کامل نداشت، به زبانی غیرانگلیسی چاپ شده بودند و از شاکویو برای اهدافی غیر از درمان اسپاستیسیتی استفاده کرده بودند از مطالعه حذف شدند. مقالات با این ویژگیها برای انجام متاآنالیز انتخاب شدند: 1. مقاله اصیل پژوهشی؛ 2. مطالعاتی که به صورت کارآزمایی بالینی با گروه کنترل یا پیش آزمونـ پسآزمون طراحی شده بود؛ 3. مطالعاتی که از مقیاس آشورت برای ارزیابی اسپاستیسیتی (حداقل در دو زمان، یکی بلافاصله پس از مداخله و دیگری سه ماه پس از شاکویوتراپی استفاده کرده بود؛ 4. مطالعاتی که از شاخصهای نوروفیزیولوژیکی جهت ارزیابی اسپاستیسیتی استفاده کرده بود. کیفیت متدولوژیک مطالعات انتخابی با استفاده از مقیاس داون و بلک ارزیابی شد. این مقیاس شامل 27 آیتم است و برای ارزیابی کیفیت متدولوژیک مطالعات تصادفی و غیرتصادفی طراحی شده است [22].
آنالیز آماری
تفاوت میانگینها به عنوان اندازه اثر در نمرات مقیاس آشورت مفصل قبل، و بلافاصله بعد از مداخله و سه ماه پس از مداخله برای انجام متاآنالیز در نظر گرفته شد. همچنین فراتحلیل دیگری روی تفاوت میانگینها در شاخصهای نورو فیزیولوژیکی قبل و بعد از مداخله انجام شد. بررسی هتروژنیسیتی (وجود یا عدم وجود همگنی) بین مطالعات با استفاده از شاخصI2 انجام شد. با توجه به تأیید ناهمگنی مطالعات (I2>%50) در تحلیل مقیاس آشورت و شاخصهای نورو فیزیولوژیکی از مدل اثرات تصادفی برای انجام متاآنالیز استفاده شد. این مدل مقدار تفاوت میانگین هر مطالعه و مقدار تفاوت میانگین ترکیبشده و همچنین فواصل اطمینان آنها را نشان میدهد. سوگیری انتشار نیز به کمک آزمون ایگر بررسی شد. دادهها با استفاده از نرمافزار STATA نسخه 11 آنالیز شدند. مقادیر P کمتر از 0/05 به عنوان مقادیر معنیدار از نظر آماری در نظر گرفته شدند.
یافتهها
با استفاده از کلمات کلیدی مذکور، درمجموع 98 مقاله در مرحله اول انتخاب یافت شد که پس از حذف 31 مقاله غیرمرتبط و 43 مقاله تکراری 24 مقاله باقی ماند. از بین این مقالات متن کامل دو مقاله یافت نشد و سه مقاله نیز کارآزمایی بالینی بر روی حیوانات بود. پنج مقاله دیگر به دلایل زیر حذف شدند: سه مطالعه مقادیر میانگین و انحراف معیار را گزارش نکرده بودند و دو مقاله از مقیاس اصلاحشده آشورت استفاده کرده بودند. در مجموع چهارده مقاله وارد بررسی سیستماتیک و متاآنالیز شدند. فلوچارت بررسی مطالعات در تصویر شماره 1 نشان داده شده است.
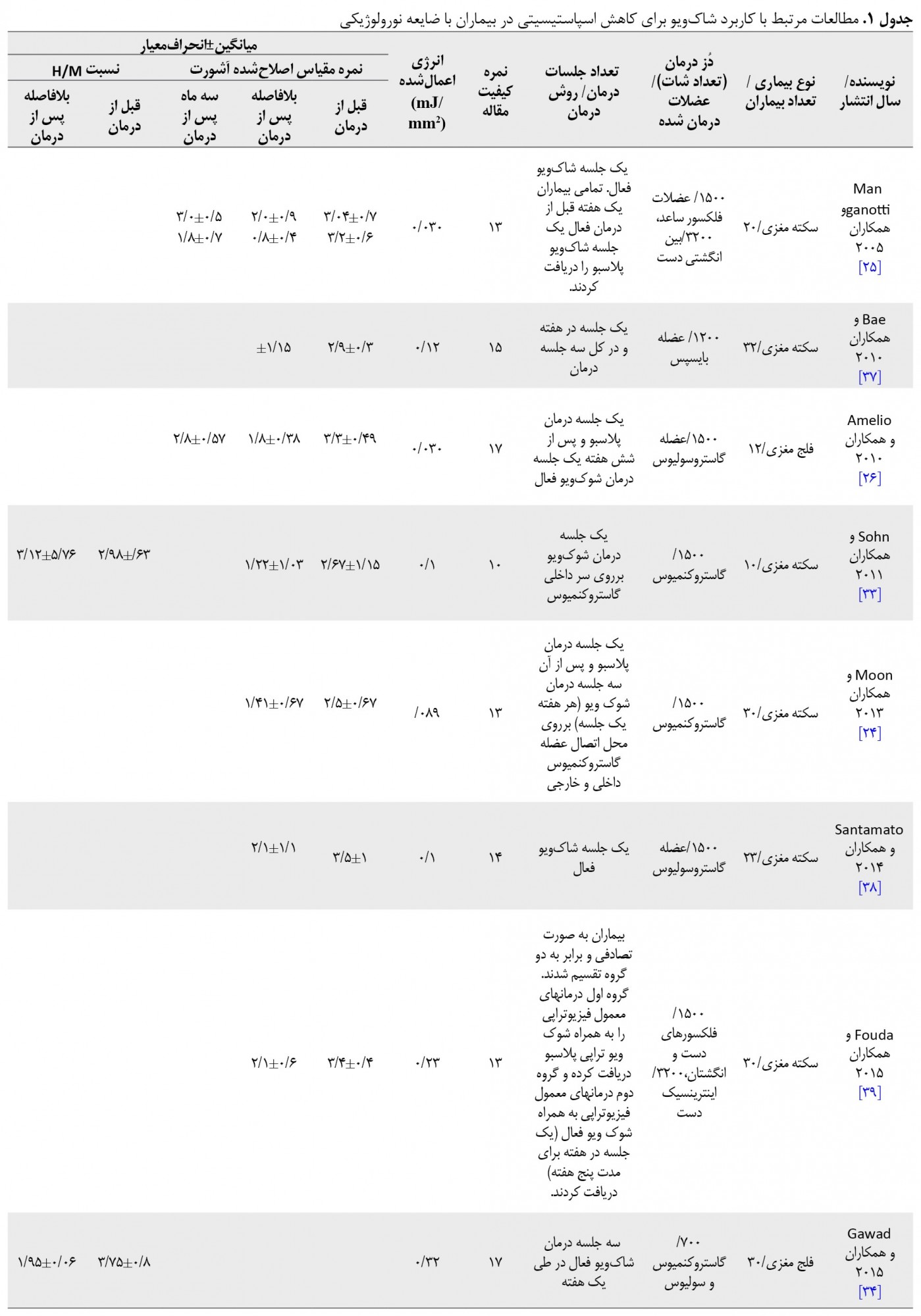
تمام مطالعات مرتبط از نظر ویژگیهای بیماران، تعداد جلسات درمان، عضلات موردبررسی، شدت و تعداد پالسهای درمان، روشهای ارزیابی و درنهایت نتایج بهدستآمده مورد تجزیه و تحلیل قرار گرفتند (جدول شماره 1).
.jpg)
کیفیت مطالعات وارد شده متغیر بود. براساس نمره داونز و بلک، یک مطالعه عالی، دو مطالعه خوب، هفت مطالعه نسبتاً خوب و چهار مطالعه با کیفیت پایین انجام شده بود. میانگین نمره ارزیابی کیفی مطالعات با استفاده از مقیاس داون و بلک 17 و در دامنه 10-27 بود. در جدول شماره 1 نمرات کیفی تمام مطالعات نشان داده شده است.
یافتههای مرور سیستماتیک
همانطور که در جدول شماره 1 آورده شده است، تفاوتهای مشاهدهشده میان مقالات در نوع بیماری، تعداد جلسات درمان، عضلات مورد بررسی و انرژی اعمالشده است.
از مجموع چهارده مقاله واردشده به مطالعه، یازده مقاله تأثیر شاکویو را در بیماران سکته مغزی، یک مطالعه در بیماران مولتیپل اسکلروز و سه مطالعه در بیماران فلج مغزی بررسی کردند که این امر احتمالاً به دلیل شیوع بیشتر بیماران سکته مغزی در جامعه است. تعداد جلسات درمانی در هفت مطالعه تکجلسهای بود و در سایر مطالعات طول مدت درمان بین سه تا شش هفته ادامه داشت؛ به طوری که بیشترین تعداد جلسات در مطالعه وانگ و همکاران با یک جلسه درمان در هفته به مدت سه ماه و درمجموع 12 جلسه بود [23]. از نظر طول اثرات درمانی شاکویو موون و همکاران به این نتیجه رسیدند که پس از گذشت زمان، اثر شاکویودرمانی کاهش مییابد [24]. در حالی که مطالعات منگناتی و همکاران [25] و آمیلیو و همکاران [26] اثرات درازمدت شاکویو را تأیید میکنند. از نظر عضلات موردبررسی، عضله گاسترو سولیوس در هشت مطالعه، عضلات فلکسور مچ دست و انگشتان در پنج مطالعه و عضله دو سر بازویی در یک مطالعه مورد بررسی قرار گرفته است.
تفاوت درپارامترهای دستگاه شوک ویو از نظر شدت انرژی مورد استفاده از 0/03 میلیمتر مربع/میلی ژول تا 0/32 میلیمتر مربع/میلی ژول متغیر بوده است. در بیشتر مطالعات از شدتهای پایین انرژی در درمان استفاده شده است، اما هیچ دلیلی در انتخاب میزان شدت کاربردی توسط محقق ارائه نشده است.
درمجموع دوازده مطالعه تأثیر شاکویودرمانی را بر نمرات مقیاس اصلاحشده آشورت ارزیابی کردند. از بین این مقالات، سه مطالعه اثر شاکویودرمانی را سه ماه پس از درمان نیز بر این مقیاس ارزیابی کردند [27, 25 ,26]. منگناتی همزمان دو گروه عضلات فلکسور ساعد و اینترینسیک دست را ارزیابی کرد [25]. وانگ در مطالعه خود عضله گاستروکنمیوس راست و چپ را جداگانه ارزیابی کرد [23]. لی عضلات اینتریسک دست را در دو گروه بیمار و عضلات فلکسور ساعد را نیز در دو گروه بررسی کرد [27].
یافتههای متاآنالیز
تحلیل نتایج مطالعات واردشده به متاآنالیز با بررسی تأثیر شاکویو بر نمرات مقیاس اصلاحشده آشورت
درمجموع 18 مداخله که تأثیر شاکویو روی نمرات مقیاس اصلاحشده آشورت را قبل و بعد از درمان و هفت مطالعه که تأثیر شاکویو بر نمرات مقیاس اصلاحشده آشورت را قبل و سه ماه پس از شاکویودرمانی مورد بررسی قرار داده بودند در متاآنالیز وارد شدند.
نتایج متاآنالیز نشاندهنده کاهش معنیدار مقیاس اصلاحشده آشورت بلافاصله پس از درمان بود، بهگو نهای که نمرات مقیاس آشورت به میزان 1/38 با فاصله اطمینان 95 درصد کاهش یافت. [I2= 100%, p<0.001, SMD=1.38 with 95% CI: (0.80, 1.87)]. تصویر شماره 2 نمودار Forest plot میزان تغییرات مقیاس آشورت قبل و بلافاصله پس از شاکویو درمانی را به طور کلی و جداگانه برای تمام مطالعات نشان میدهد.

.jpg)
کیفیت مطالعات وارد شده متغیر بود. براساس نمره داونز و بلک، یک مطالعه عالی، دو مطالعه خوب، هفت مطالعه نسبتاً خوب و چهار مطالعه با کیفیت پایین انجام شده بود. میانگین نمره ارزیابی کیفی مطالعات با استفاده از مقیاس داون و بلک 17 و در دامنه 10-27 بود. در جدول شماره 1 نمرات کیفی تمام مطالعات نشان داده شده است.
یافتههای مرور سیستماتیک
همانطور که در جدول شماره 1 آورده شده است، تفاوتهای مشاهدهشده میان مقالات در نوع بیماری، تعداد جلسات درمان، عضلات مورد بررسی و انرژی اعمالشده است.
از مجموع چهارده مقاله واردشده به مطالعه، یازده مقاله تأثیر شاکویو را در بیماران سکته مغزی، یک مطالعه در بیماران مولتیپل اسکلروز و سه مطالعه در بیماران فلج مغزی بررسی کردند که این امر احتمالاً به دلیل شیوع بیشتر بیماران سکته مغزی در جامعه است. تعداد جلسات درمانی در هفت مطالعه تکجلسهای بود و در سایر مطالعات طول مدت درمان بین سه تا شش هفته ادامه داشت؛ به طوری که بیشترین تعداد جلسات در مطالعه وانگ و همکاران با یک جلسه درمان در هفته به مدت سه ماه و درمجموع 12 جلسه بود [23]. از نظر طول اثرات درمانی شاکویو موون و همکاران به این نتیجه رسیدند که پس از گذشت زمان، اثر شاکویودرمانی کاهش مییابد [24]. در حالی که مطالعات منگناتی و همکاران [25] و آمیلیو و همکاران [26] اثرات درازمدت شاکویو را تأیید میکنند. از نظر عضلات موردبررسی، عضله گاسترو سولیوس در هشت مطالعه، عضلات فلکسور مچ دست و انگشتان در پنج مطالعه و عضله دو سر بازویی در یک مطالعه مورد بررسی قرار گرفته است.
تفاوت درپارامترهای دستگاه شوک ویو از نظر شدت انرژی مورد استفاده از 0/03 میلیمتر مربع/میلی ژول تا 0/32 میلیمتر مربع/میلی ژول متغیر بوده است. در بیشتر مطالعات از شدتهای پایین انرژی در درمان استفاده شده است، اما هیچ دلیلی در انتخاب میزان شدت کاربردی توسط محقق ارائه نشده است.
درمجموع دوازده مطالعه تأثیر شاکویودرمانی را بر نمرات مقیاس اصلاحشده آشورت ارزیابی کردند. از بین این مقالات، سه مطالعه اثر شاکویودرمانی را سه ماه پس از درمان نیز بر این مقیاس ارزیابی کردند [27, 25 ,26]. منگناتی همزمان دو گروه عضلات فلکسور ساعد و اینترینسیک دست را ارزیابی کرد [25]. وانگ در مطالعه خود عضله گاستروکنمیوس راست و چپ را جداگانه ارزیابی کرد [23]. لی عضلات اینتریسک دست را در دو گروه بیمار و عضلات فلکسور ساعد را نیز در دو گروه بررسی کرد [27].
یافتههای متاآنالیز
تحلیل نتایج مطالعات واردشده به متاآنالیز با بررسی تأثیر شاکویو بر نمرات مقیاس اصلاحشده آشورت
درمجموع 18 مداخله که تأثیر شاکویو روی نمرات مقیاس اصلاحشده آشورت را قبل و بعد از درمان و هفت مطالعه که تأثیر شاکویو بر نمرات مقیاس اصلاحشده آشورت را قبل و سه ماه پس از شاکویودرمانی مورد بررسی قرار داده بودند در متاآنالیز وارد شدند.
نتایج متاآنالیز نشاندهنده کاهش معنیدار مقیاس اصلاحشده آشورت بلافاصله پس از درمان بود، بهگو نهای که نمرات مقیاس آشورت به میزان 1/38 با فاصله اطمینان 95 درصد کاهش یافت. [I2= 100%, p<0.001, SMD=1.38 with 95% CI: (0.80, 1.87)]. تصویر شماره 2 نمودار Forest plot میزان تغییرات مقیاس آشورت قبل و بلافاصله پس از شاکویو درمانی را به طور کلی و جداگانه برای تمام مطالعات نشان میدهد.
با فاصله اطمینان95 درصد، تفاوت میانگین در مقایسه قبل و بلافاصله بعد مقیاس آشورت برابر 0/80 و 1/87 به دست آمد که نشان میدهد میانگین مقیاس آشورت قبل و بلافاصله بعد از مداخله تفاوت معنیدار دارد.
نتایج متاآنالیز همچنین نشان داد که سه ماه پس از مداخله، نمرات مقیاس اصلاحشده آشورت به طور قابل توجهی کاهش یافته است [I2 = 100%, p<0.001, SMD=1.13 with 95% CI: (0.50, 1.76)]. در تصویر شماره 3 نمودار Forest plot میزان تغییرات مقیاس آشورت قبل و سه ماه پس از شاکویودرمانی را به طور کلی و جداگانه برای تمام مطالعات نشان داده است.
نتایج متاآنالیز همچنین نشان داد که سه ماه پس از مداخله، نمرات مقیاس اصلاحشده آشورت به طور قابل توجهی کاهش یافته است [I2 = 100%, p<0.001, SMD=1.13 with 95% CI: (0.50, 1.76)]. در تصویر شماره 3 نمودار Forest plot میزان تغییرات مقیاس آشورت قبل و سه ماه پس از شاکویودرمانی را به طور کلی و جداگانه برای تمام مطالعات نشان داده است.
با فاصله اطمینان 95 درصد، تفاوت میانگین در مقایسه قبل و سه ماه بعد مقیاس آشورت برابر 0/50 و 1/76 به دست آمد که نشان میدهد میانگین مقیاس آشورت قبل و سه ماه بعد از مداخله تفاوت معنیدار دارد.
تحلیل نتایج مطالعات واردشده به متاآنالیز با بررسی تأثیر شاکویو برنسبت H/M
چهار مطالعه با مجموع 120 بیمار، اثرات شاکویودرمانی را بر نسبت H/M ارزیابی کردند. تصویر شماره 4 نشاندهنده نمودار Forest plot و میزان تغییرات نسبت H/M قبل و بعد از شاکویودرمانی به طور کلی و جداگانه برای تمام مطالعات است.
تحلیل نتایج مطالعات واردشده به متاآنالیز با بررسی تأثیر شاکویو برنسبت H/M
چهار مطالعه با مجموع 120 بیمار، اثرات شاکویودرمانی را بر نسبت H/M ارزیابی کردند. تصویر شماره 4 نشاندهنده نمودار Forest plot و میزان تغییرات نسبت H/M قبل و بعد از شاکویودرمانی به طور کلی و جداگانه برای تمام مطالعات است.
فاصله اطمینان 95 درصد، تفاوت میانگین در مقایسه قبل و بعد نسبت H/M برابر -0/54 و 2/73 به دست آمد که نشان میدهد میانگین شاخص نسبتH/M قبل و بعد از مداخله تفاوت معنیدار ندارد.
بحث
به طور کلی یکی از مهمترین اهداف مطالعات متاآنالیز حل مشکلات ناشی از نتایج بحثانگیز مطالعات گذشته است در این مطالعات با ترکیب چندین مطالعه با ویژگیهای مشخص، حجم نمونه افزایش مییابد که این امر خود سبب کاهش فاصله اطمینان اندازهگیریها میشود. درنتیجه میتوان یک نتیجه معتبر را از مطالعات گذشته ارائه کرد [28].
نتیجه مطالعه حاضر نشان داد که درجه مقیاس آشورت پس از اعمال شاکویو به طور معنیداری کاهش مییابد. در این متاآنالیز اثرات شاکویو بر کاهش اسپاستیسیته در پیگیری سه ماه پس از درمان نیز معنیدار بود. تا کنون چند مطالعه مرور سیستماتیک و متاآنالیز با هدف بررسی اثر شاکویودرمانی بر اسپاستیسیته در بیماران با ضایعات نورون محرکه فوقانی انجام شده است، اما تا کنون مطالعهای در زمینه بررسی همزمان اثرات شاکویودرمانی روی علائم بالینی و نوروفیزیولوژیکی اسپاستیسیتی در بیماران ضایعات نورون محرکه فوقانی با اتیولوژیهای متفاوت انجام نشده است.
نتایج سایر مطالعات مروری که اثر شاکویودرمانی را بر شدت اسپاستیسیته بررسی کردهاند با نتایج مطالعه حاضر همخوانی دارد. لی و همکاران در یک مطالعه مروری با بررسی پنج مطالعه (سه مطالعه در بیماران فلج نیمه بدن و دو مطالعه در بیماران فلج مغزی) اظهار کردند که مقیاس اصلاحشده آشورت بلافاصله و چهار هفته پس از شاکویودرمانی به طور معنیداری در مقایسه با مقادیر پایه بهبود یافته است [29].
گاوود و همکاران در مطالعه خود به روش مرور سیستماتیک و متاآنالیز و بر اساس دادههای حاصل از شش مطالعه در بیماران سکته مغزی، اثرات شاکویودرمانی را در کاهش اسپاستیسیته مورد تجزیه و تحلیل قرار دادند و اختلاف معنیداری میان مقادیر پایه مقیاس آشورت بلافاصله و چهار هقته پس از درمان گزارش کردند [30].
زانگ و همکاران با مرور سیستماتیک و متاآنالیز هشت مطالعه کارآزمایی بالینی انجامشده در بیماران سکته مغزی گزارش کردند که سطح بالایی از شواهد در تأیید اثرات مثبت شاکویودرمانی در کاهش اسپاستیسیتی بلافاصله پس از درمان وجود دارد. در این مطالعه مقیاس آشورت، مقیاس تاردیو، نسبت H/M و دامنه حرکتی مفصل مورد تجزیه و تحلیل قرار گرفته بود [31].
در مرور سیستماتیک و متا
در آنالیز انجامشده در سال 2020 توسط والدز و همکاران نیز نتایجی مشابه با نتایج مطالعه حاضر به دست آمد. نویسنده در دو مقاله جداگانه با بررسی اثرات شاکویودرمانی در کاهش اسپاستیسیته عضلات اندام تحتانی و فوقانی بیماران فلج نیمه بدن، گزارش کرد که شاکویودرمانی اثرات معنیداری بر بهبود مقیاس اصلاحشده آشورت، دامنه حرکتی و معیار Fugl Meyer به صورت کوتاهمدت و بلندمدت دارد [10].
یافته دیگر این مطالعه نشان داد که تغییرات معنیداری در تحریکپذیری نورون حرکتی آلفا (نسبت H/M) در بیماران با ضایعات نورون محرکه فوقانی پس از درمان با شاکویو وجود ندارد.
این یافته مغایر با یافته مطالعه مروری گوآ و همکاران است [30]. نکته قابل تأمل در مطالعه گوآ و همکاران این است که اثرات شاکویودرمانی روی نسبت H/M تنها با متاآنالیز یک مطالعه انجامشده بود، در حالی که در مطالعه حاضر با توجه به معیارهای ورود چهار مقاله مورد تجزیه و تحلیل آماری متاآنالیز قرار گرفتند، بنابراین این امر میتواند توجیهی بر وجود مغایرت میان یافته مطالعه حاضر با مطالعه گوآ باشد.
در این زمینه بر اساس معیارهای ورود، چهار مقاله که به بررسی اثرات آنی شاکویودرمانی عضله اسپاستیک روی نسبت H/M پرداخته بودند، وارد این مطالعه شدند. رادینمهر و همکاران با اعمال یک جلسه شاکویو روی عضله گاستروکنمیوس دوازده بیمار سکته مغزی و ثبت نسبت H/M بلافاصله و یک ساعت پس از درمان، گزارش کردند که علیرغم کاهش زمان تأخیر رفلکس H، تغییری در نسبت H/M پس از این زمانها مشاهده نشد [32]. شان و همکاران در مطالعه خود با بررسی ده بیمار سکته مغزی گزارش کردند که یک جلسه شاکویودرمانی روی عضله گاسترو سولئوس تغییرات معنیداری در نسبت H/M نسبت به قبل از درمان ندارد [33]. در مطالعه گاوود و همکاران کاهش معنیداری در نسبت H/M پس از سه جلسه درمان بیمارن مبتلا به فلج مغزی مشاهده شد [34]. مارینلی و همکاران گزارش کردند که چهار جلسه شاکویودرمانی قادر به کاهش معنیدار شاخصهای الکترو فیزیولوژیکی در بیماران مولتیپل اسکلروز است [35].
نکته قابل تأمل در مطالعاتی که به بررسی نسبت H/M بر شدت اسپاستیسیتی پرداختهاند فاصله زمانی از شروع ضایعه نورون محرکه فوقانی است. هرچند که نسبت H/M یک اندازهگیری قابل اعتماد از تحریکپذیری نورون محرکه فوقانی است، اما مطالعاتی که از نسبت H/M برای ارزیابی اسپاستیسیتی استفاده کردهاند، شروع ضایعات نورون محرکه فوقانی برای بیماران مبتلا را ذکر نکردهاند. هایرزمنزول و همکاران گزارش کردهاند که نسبت H/M حداقل دو تا شش ماه پس از شروع ضایعه نورون محرکه فوقانی به حداکثر مقدارخود میرسد و پس از آن ثابت میماند [36]، بنابراین ممکن است نسبت H/M قبل از این زمان هنوز پایدار نشده باشد، بنابراین به نظر میرسد ارزیابی بیماران از نظر شاخص نسبت H/M با توجه به زمان شروع عارضه، عامل مهمی در نتیجه ارزیابی باشد و میتواند نتایج مطالعه را تحت تأثیر قراردهد. توصیه میشود که مطالعاتی که از این نسبت برای ارزیابی اثرات درمانهای مختلف بر اسپاستیسیتی استفاده میکنند، زمان سپری شدن از شروع ضایعه نورون محرکه فوقانی را در نظر داشته باشد.
با وجودی که نتایج تمامی مطالعات، تأییدکننده اثرات مثبت شاکویودرمانی در کاهش اسپاستیسیته بر اساس مقیاس آشورت است، اما به نظر میرسد قبل از اینکه بتوان این روش را به عنوان روش معمول کاهش اسپاستیسیته به بیماران توصیه کرد، باید به بسیاری از سؤالات پاسخ داده شود.
اولأ برای تعیین اثر مستقل شاکویو بر اسپاستیسیتی، ضروری است که استفاده از هر روش درمانی دیگر که میتواند بر روی شدت اسپاستیسیتی اثرگذار باشد را محدود کرد تا از سردرگمی در بیان نتایج جلوگیری شود، به عنوان مثال گاوود و همکاران در مطالعه خود به همراه شاکویودرمانی از پروتکل ورزشدرمانی در گروه کنترل و درمان استفاده کردند [34]. وانگ و همکاران از ماساژ چینی و تحریک الکتریکی به همراه شاکویودرمانی استفاده کردند [23]. شان و همکاران در مطالعه خود از داروهای ضداسپاستیسیتی به همراه شاکویو استفاده کردند [33]. از طرفی تفاوت در تعداد جلسات درمانی، فواصل جلسات درمان، چگالی انرژی و تعداد شاکهای اعمالشده و مدتزمان پیگیری نیاز به بررسی دقیقتر دارد. وجود این تفاوتها به طور قابل توجهی سطح ناهمگنی در مطالعات را بالا میبرد، بنابراین مشاهده میشود به این دلیل که دادههای کافی از مقالات اصلی برای متاآنالیز در مورد متغیرهای مذکور وجود ندارد، در هیچیک از مطالعات مروری و متاآنالیز، اثر شاکویودرمانی با شوکها و شدتهای مختلف و طول درمانهای متفاوت تجزیه و تحلیل نشده است
از جمله محدودیتهای این مطالعه میتوان به کم بودن تعداد کارآزماییهای بالینی با طراحی مناسب اشاره کرد. با توجه به اینکه مکانیسم اثربخشی شاکویودرمانی بر اسپاستیسیتی هنوز به طور کامل مشخص نیست و از طرفی پروتکل پکپارچهای در درمان اسپاستیسیتی توسط شاکویودرمانی وجود ندارد، بنابر این کارآزماییهای بیشتر با طراحیهای مناسب در آینده مورد نیاز است.
نتیجهگیری
نتایج این مطالعه مروری نشان داد که شاکویودرمانی روشی غیرتهاجمی است که بهراحتی در عضلات اسپاستیک اندام تحتانی و فوقانی در بیماران با ضایعات نورون محرکه فوقانی قابل استفاده است و اثرات مفیدی بر بهبود مقیاس بالینی ارزیابی اسپاستیسیتی دارد. با توجه به اینکه هنوز دستورالعمل واحدی جهت درمان بیماران از نظر تعداد جلسات درمانی، شدت انرژی و تعداد شوک اعمالشده وجود ندارد و از طرفی در هیچکدام از مطالعات دلیل مستندی بر علت انتخاب تعداد جلسات و شدت پالسها ارائه نشده است، برای اینکه بتوان این روش را به عنوان روش معمول کاهش اسپاستیسیته به بیماران ارائه داد، مطالعات بالینی تصادفی با طراحی و کیفیت بالا برای تجزیه و تحلیل عوامل مؤثر بر شاکویودرمانی در اسپاستیسیته مورد نیاز است.
توصیه میشود در مطالعات آینده کارآزماییهای بالینی با این طراحی انجام شود. اولاً بیماران به گروههای مختلف بر اساس ویژگیهای موج شاکویو، تعداد جلسات درمان و مدتزمان پیگیری تقسیم شوند. در ثانی نمونهها از نظر مقیاس آشورت همسانسازی شوند. همچنین فاکتورهای مرتبط با ایجاد اسپاستیسیتی (نوع ضایعه نورون محرکه فوقانی و حتی نوع سکته مغزی) نیز در انتخاب بیماران لحاظ شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مقاله یک مطالعه متاآنالیز است و هیچ نمونه انسانی یا حیوانی ندارد.
حامی مالی
این مقاله با حمایت مالی معاونت تحقیقات و فنآوری دانشگاه علوم پزشکی شهید بهشتی انجام گرفته است.
مشارکت نویسندگان
مفهومسازی و مدیریت پروژه: ناهید طحان؛ تحقیق و بررسی: ناهید طحان و فریده دهقان منشادی؛ جمعآوری دادهها: ناهید طحان و فرشته پورسعید؛ ویراستاری و نهاییسازی نوشته: تمامی نویسندگان؛ تحلیل آماری: علیرضا اکبر زاده باغبان.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از معاونت تحقیقات و فنآوری دانشگاه علوم پزشکی شهید بهشتی کمال تشکر را دارند.
بحث
به طور کلی یکی از مهمترین اهداف مطالعات متاآنالیز حل مشکلات ناشی از نتایج بحثانگیز مطالعات گذشته است در این مطالعات با ترکیب چندین مطالعه با ویژگیهای مشخص، حجم نمونه افزایش مییابد که این امر خود سبب کاهش فاصله اطمینان اندازهگیریها میشود. درنتیجه میتوان یک نتیجه معتبر را از مطالعات گذشته ارائه کرد [28].
نتیجه مطالعه حاضر نشان داد که درجه مقیاس آشورت پس از اعمال شاکویو به طور معنیداری کاهش مییابد. در این متاآنالیز اثرات شاکویو بر کاهش اسپاستیسیته در پیگیری سه ماه پس از درمان نیز معنیدار بود. تا کنون چند مطالعه مرور سیستماتیک و متاآنالیز با هدف بررسی اثر شاکویودرمانی بر اسپاستیسیته در بیماران با ضایعات نورون محرکه فوقانی انجام شده است، اما تا کنون مطالعهای در زمینه بررسی همزمان اثرات شاکویودرمانی روی علائم بالینی و نوروفیزیولوژیکی اسپاستیسیتی در بیماران ضایعات نورون محرکه فوقانی با اتیولوژیهای متفاوت انجام نشده است.
نتایج سایر مطالعات مروری که اثر شاکویودرمانی را بر شدت اسپاستیسیته بررسی کردهاند با نتایج مطالعه حاضر همخوانی دارد. لی و همکاران در یک مطالعه مروری با بررسی پنج مطالعه (سه مطالعه در بیماران فلج نیمه بدن و دو مطالعه در بیماران فلج مغزی) اظهار کردند که مقیاس اصلاحشده آشورت بلافاصله و چهار هفته پس از شاکویودرمانی به طور معنیداری در مقایسه با مقادیر پایه بهبود یافته است [29].
گاوود و همکاران در مطالعه خود به روش مرور سیستماتیک و متاآنالیز و بر اساس دادههای حاصل از شش مطالعه در بیماران سکته مغزی، اثرات شاکویودرمانی را در کاهش اسپاستیسیته مورد تجزیه و تحلیل قرار دادند و اختلاف معنیداری میان مقادیر پایه مقیاس آشورت بلافاصله و چهار هقته پس از درمان گزارش کردند [30].
زانگ و همکاران با مرور سیستماتیک و متاآنالیز هشت مطالعه کارآزمایی بالینی انجامشده در بیماران سکته مغزی گزارش کردند که سطح بالایی از شواهد در تأیید اثرات مثبت شاکویودرمانی در کاهش اسپاستیسیتی بلافاصله پس از درمان وجود دارد. در این مطالعه مقیاس آشورت، مقیاس تاردیو، نسبت H/M و دامنه حرکتی مفصل مورد تجزیه و تحلیل قرار گرفته بود [31].
در مرور سیستماتیک و متا
در آنالیز انجامشده در سال 2020 توسط والدز و همکاران نیز نتایجی مشابه با نتایج مطالعه حاضر به دست آمد. نویسنده در دو مقاله جداگانه با بررسی اثرات شاکویودرمانی در کاهش اسپاستیسیته عضلات اندام تحتانی و فوقانی بیماران فلج نیمه بدن، گزارش کرد که شاکویودرمانی اثرات معنیداری بر بهبود مقیاس اصلاحشده آشورت، دامنه حرکتی و معیار Fugl Meyer به صورت کوتاهمدت و بلندمدت دارد [10].
یافته دیگر این مطالعه نشان داد که تغییرات معنیداری در تحریکپذیری نورون حرکتی آلفا (نسبت H/M) در بیماران با ضایعات نورون محرکه فوقانی پس از درمان با شاکویو وجود ندارد.
این یافته مغایر با یافته مطالعه مروری گوآ و همکاران است [30]. نکته قابل تأمل در مطالعه گوآ و همکاران این است که اثرات شاکویودرمانی روی نسبت H/M تنها با متاآنالیز یک مطالعه انجامشده بود، در حالی که در مطالعه حاضر با توجه به معیارهای ورود چهار مقاله مورد تجزیه و تحلیل آماری متاآنالیز قرار گرفتند، بنابراین این امر میتواند توجیهی بر وجود مغایرت میان یافته مطالعه حاضر با مطالعه گوآ باشد.
در این زمینه بر اساس معیارهای ورود، چهار مقاله که به بررسی اثرات آنی شاکویودرمانی عضله اسپاستیک روی نسبت H/M پرداخته بودند، وارد این مطالعه شدند. رادینمهر و همکاران با اعمال یک جلسه شاکویو روی عضله گاستروکنمیوس دوازده بیمار سکته مغزی و ثبت نسبت H/M بلافاصله و یک ساعت پس از درمان، گزارش کردند که علیرغم کاهش زمان تأخیر رفلکس H، تغییری در نسبت H/M پس از این زمانها مشاهده نشد [32]. شان و همکاران در مطالعه خود با بررسی ده بیمار سکته مغزی گزارش کردند که یک جلسه شاکویودرمانی روی عضله گاسترو سولئوس تغییرات معنیداری در نسبت H/M نسبت به قبل از درمان ندارد [33]. در مطالعه گاوود و همکاران کاهش معنیداری در نسبت H/M پس از سه جلسه درمان بیمارن مبتلا به فلج مغزی مشاهده شد [34]. مارینلی و همکاران گزارش کردند که چهار جلسه شاکویودرمانی قادر به کاهش معنیدار شاخصهای الکترو فیزیولوژیکی در بیماران مولتیپل اسکلروز است [35].
نکته قابل تأمل در مطالعاتی که به بررسی نسبت H/M بر شدت اسپاستیسیتی پرداختهاند فاصله زمانی از شروع ضایعه نورون محرکه فوقانی است. هرچند که نسبت H/M یک اندازهگیری قابل اعتماد از تحریکپذیری نورون محرکه فوقانی است، اما مطالعاتی که از نسبت H/M برای ارزیابی اسپاستیسیتی استفاده کردهاند، شروع ضایعات نورون محرکه فوقانی برای بیماران مبتلا را ذکر نکردهاند. هایرزمنزول و همکاران گزارش کردهاند که نسبت H/M حداقل دو تا شش ماه پس از شروع ضایعه نورون محرکه فوقانی به حداکثر مقدارخود میرسد و پس از آن ثابت میماند [36]، بنابراین ممکن است نسبت H/M قبل از این زمان هنوز پایدار نشده باشد، بنابراین به نظر میرسد ارزیابی بیماران از نظر شاخص نسبت H/M با توجه به زمان شروع عارضه، عامل مهمی در نتیجه ارزیابی باشد و میتواند نتایج مطالعه را تحت تأثیر قراردهد. توصیه میشود که مطالعاتی که از این نسبت برای ارزیابی اثرات درمانهای مختلف بر اسپاستیسیتی استفاده میکنند، زمان سپری شدن از شروع ضایعه نورون محرکه فوقانی را در نظر داشته باشد.
با وجودی که نتایج تمامی مطالعات، تأییدکننده اثرات مثبت شاکویودرمانی در کاهش اسپاستیسیته بر اساس مقیاس آشورت است، اما به نظر میرسد قبل از اینکه بتوان این روش را به عنوان روش معمول کاهش اسپاستیسیته به بیماران توصیه کرد، باید به بسیاری از سؤالات پاسخ داده شود.
اولأ برای تعیین اثر مستقل شاکویو بر اسپاستیسیتی، ضروری است که استفاده از هر روش درمانی دیگر که میتواند بر روی شدت اسپاستیسیتی اثرگذار باشد را محدود کرد تا از سردرگمی در بیان نتایج جلوگیری شود، به عنوان مثال گاوود و همکاران در مطالعه خود به همراه شاکویودرمانی از پروتکل ورزشدرمانی در گروه کنترل و درمان استفاده کردند [34]. وانگ و همکاران از ماساژ چینی و تحریک الکتریکی به همراه شاکویودرمانی استفاده کردند [23]. شان و همکاران در مطالعه خود از داروهای ضداسپاستیسیتی به همراه شاکویو استفاده کردند [33]. از طرفی تفاوت در تعداد جلسات درمانی، فواصل جلسات درمان، چگالی انرژی و تعداد شاکهای اعمالشده و مدتزمان پیگیری نیاز به بررسی دقیقتر دارد. وجود این تفاوتها به طور قابل توجهی سطح ناهمگنی در مطالعات را بالا میبرد، بنابراین مشاهده میشود به این دلیل که دادههای کافی از مقالات اصلی برای متاآنالیز در مورد متغیرهای مذکور وجود ندارد، در هیچیک از مطالعات مروری و متاآنالیز، اثر شاکویودرمانی با شوکها و شدتهای مختلف و طول درمانهای متفاوت تجزیه و تحلیل نشده است
از جمله محدودیتهای این مطالعه میتوان به کم بودن تعداد کارآزماییهای بالینی با طراحی مناسب اشاره کرد. با توجه به اینکه مکانیسم اثربخشی شاکویودرمانی بر اسپاستیسیتی هنوز به طور کامل مشخص نیست و از طرفی پروتکل پکپارچهای در درمان اسپاستیسیتی توسط شاکویودرمانی وجود ندارد، بنابر این کارآزماییهای بیشتر با طراحیهای مناسب در آینده مورد نیاز است.
نتیجهگیری
نتایج این مطالعه مروری نشان داد که شاکویودرمانی روشی غیرتهاجمی است که بهراحتی در عضلات اسپاستیک اندام تحتانی و فوقانی در بیماران با ضایعات نورون محرکه فوقانی قابل استفاده است و اثرات مفیدی بر بهبود مقیاس بالینی ارزیابی اسپاستیسیتی دارد. با توجه به اینکه هنوز دستورالعمل واحدی جهت درمان بیماران از نظر تعداد جلسات درمانی، شدت انرژی و تعداد شوک اعمالشده وجود ندارد و از طرفی در هیچکدام از مطالعات دلیل مستندی بر علت انتخاب تعداد جلسات و شدت پالسها ارائه نشده است، برای اینکه بتوان این روش را به عنوان روش معمول کاهش اسپاستیسیته به بیماران ارائه داد، مطالعات بالینی تصادفی با طراحی و کیفیت بالا برای تجزیه و تحلیل عوامل مؤثر بر شاکویودرمانی در اسپاستیسیته مورد نیاز است.
توصیه میشود در مطالعات آینده کارآزماییهای بالینی با این طراحی انجام شود. اولاً بیماران به گروههای مختلف بر اساس ویژگیهای موج شاکویو، تعداد جلسات درمان و مدتزمان پیگیری تقسیم شوند. در ثانی نمونهها از نظر مقیاس آشورت همسانسازی شوند. همچنین فاکتورهای مرتبط با ایجاد اسپاستیسیتی (نوع ضایعه نورون محرکه فوقانی و حتی نوع سکته مغزی) نیز در انتخاب بیماران لحاظ شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مقاله یک مطالعه متاآنالیز است و هیچ نمونه انسانی یا حیوانی ندارد.
حامی مالی
این مقاله با حمایت مالی معاونت تحقیقات و فنآوری دانشگاه علوم پزشکی شهید بهشتی انجام گرفته است.
مشارکت نویسندگان
مفهومسازی و مدیریت پروژه: ناهید طحان؛ تحقیق و بررسی: ناهید طحان و فریده دهقان منشادی؛ جمعآوری دادهها: ناهید طحان و فرشته پورسعید؛ ویراستاری و نهاییسازی نوشته: تمامی نویسندگان؛ تحلیل آماری: علیرضا اکبر زاده باغبان.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از معاونت تحقیقات و فنآوری دانشگاه علوم پزشکی شهید بهشتی کمال تشکر را دارند.
References
1.Katz RT, Rymer WZ. Spastic hypertonia: Mechanisms and measurement. Archives of Physical Medicine and Rehabilitation. 1989; 70(2):144-55. [DOI:10.5555/uri:pii:0003999389901342]
2.Bar-On L, Molenaers G, Aertbeliën E, Van Campenhout A, Feys H, Nuttin B, et al. Spasticity and its contribution to hypertonia in cerebral palsy. BioMed Research International. 2015. [DOI:10.1155/2015/317047] [PMID] [PMCID]
3.Katozian L, Tahan N, MohseniBandpei MA, JamBarsang S. Spasticity following stroke: A systematic review and meta-analysis. Journal of Mazandaran University of Medical Sciences. 2015; 25(123):230-45. https://www.researchgate.net/profile/Mohammad-Mohseni-Bandpei/publication/280444247_Motor_Learning_and_Movement_Performance_Aged_versus_Younger_Adults/links/55b6317208aec0e5f436ec17/Motor-Learning-and-Movement-Performance-Aged-versus-Younger-Adults.pdf
4.Rizzo MA, Hadjimichael OC, Preiningerova J, Vollmer TL. Prevalence and treatment of spasticity reported by Multiple Sclerosis Patients. Multiple Sclerosis Journal. 2004; 10(5):589-95. [DOI:10.1191/1352458504ms1085oa] [PMID]
5.Adams MM, Hicks AL. Spasticity after spinal cord injury. Spinal cord. 2005; 43(10):577-86. [DOI:10.1038/sj.sc.3101757] [PMID]
6.Mukherjee A, Chakravarty A. Spasticity mechanisms–for the clinician. Frontiers in Neurology. 2010; 1:149. [DOI:10.3389/fneur.2010.00149] [PMID] [PMCID]
7.O’dwyer N, Ada L, Neilson P. Spasticity and muscle contracture following stroke. Brain. 1996; 119(5):1737-49. [DOI:10.1093/brain/119.5.1737] [PMID]
8.Goldstein EM. Spasticity management: an overview. Journal of Child Neurology. 2001; 16(1):16-23. [DOI:10.1177/088307380101600104] [PMID]
9.Azimpour D, Tahan N. [The effect of three sessions shock wave therapy on spasticity and range of motion of lower limb in stroke patients (Persian)]. Tehran University Medical Journal TUMS Publications. 2019; 77(4):234-9. http://tumj.tums.ac.ir/article-1-9767-en.html
10.Cabanas-Valdés R, Calvo-Sanz J, Urrùtia G, Serra-Llobet P, Pérez-Bellmunt A, Germán-Romero A. The effectiveness of extracorporeal shock wave therapy to reduce lower limb spasticity in stroke patients: A systematic review and meta-analysis. Topics in Stroke Rehabilitation. 2020; 27(2):137-57. [DOI:10.1080/10749357.2019.1654242] [PMID]
11.Ogden JA, Tóth-Kischkat A, Schultheiss R. Principles of shock wave therapy. Clinical Orthopaedics and Related Research. 2001; 387:8-17. [DOI:10.1097/00003086-200106000-00003] [PMID]
12.Wang CJ. An overview of shock wave therapy in musculoskeletal disorders. Chang Gung Medical Journal. 2003; 26(4):220-32. http://cgmj.cgu.edu.tw/2604/260400.pdf
13.Romeo P, Lavanga V, Pagani D, Sansone V. Extracorporeal shock wave therapy in musculoskeletal disorders: a review. Medical Principles and Practice. 2014; 23(1):7-13. https://www.karger.com/Article/Abstract/355472
14.Takahashi N, Ohtori S, Saisu T, Moriya H, Wada Y. Second application of low-energy shock waves has a cumulative effect on free nerve endings. Clinical Orthopaedics and Related Research (1976-2007). 2006; 443:315-9. [DOI:10.1097/01.blo.0000188064.56091.a7] [PMID]
15.Kenmoku T, Ochiai N, Ohtori S, Saisu T, Sasho T, Nakagawa K, et al. Degeneration and recovery of the neuromuscular junction after application of extracorporeal shock wave therapy. Journal of Orthopaedic Research. 2012; 30(10):1660-5. [DOI:10.1002/jor.22111] [PMID]
16.Poursaeed F, Tahan N. Assessment of spasticity in patients with stroke (systematic review of literature). Journal of Rehabilitation Medicine. 2016; 5(1):190-208. [DOI:10.22037/JRM.2016.1100265]
17.Voerman GE, Gregorič M, Hermens HJ. Neurophysiological methods for the assessment of spasticity: The Hoffmann reflex, the tendon reflex, and the stretch reflex. Disability and Rehabilitation. 2005; 27(1-2):33-68. [DOI:10.1080/09638280400014600] [PMID]
18.Rekand T. Clinical assessment and management of spasticity: A review. Acta Neurologica Scandinavica. 2010; 122(s190):62-6. [DOI:10.1111/j.1600-0404.2010.01378.x] [PMID]
19.Lee CH, Lee SH, Yoo JI, Lee SU. Ultrasonographic evaluation for the effect of extracorporeal shock wave therapy on gastrocnemius muscle spasticity in patients with chronic stroke. PM & R. 2019; 11(4):363-71. [DOI:10.1016/j.pmrj.2018.08.379] [PMID]
20.Yoo SD, Kim HS, Jung PK. The effect of shock wave therapy on upper limb spasticityin the patients with stroke. Journal of Korean Academy of Rehabilitation Medicine. 2008; 32(4):406-10. https://www.koreamed.org/SearchBasic.php?RID=2325131
21.Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JP, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. Journal of Clinical Epidemiology. 2009; 62(10):e1-e34. [DOI:10.1016/j.jclinepi.2009.06.006] [PMID]
22.Subramanian SK, Caramba SM, Hernandez OL, Morgan QT, Cross MK, Hirschhauser CS. Is the Downs and Black scale a better tool to appraise the quality of the studies using virtual rehabilitation for post-stroke upper limb rehabilitation? Paper presentetd at: 2019 International Conference on Virtual Rehabilitation (ICVR). 2019 July 21; Tel Aviv, Israel. [DOI:10.1109/ICVR46560.2019.8994724]
23.Wang T, Du L, Shan L, Dong H, Feng J, Kiessling MC, et al. A prospective case-control study of radial extracorporeal shock wave therapy for spastic plantar flexor muscles in very young children with cerebral palsy. Medicine. 2016; 95(19):e3649. [DOI:10.1097/MD.0000000000003649] [PMID] [PMCID]
24.Moon SW, Kim JH, Jung MJ, Son S, Lee JH, Shin H, et al. The effect of extracorporeal shock wave therapy on lower limb spasticity in subacute stroke patients. Annals of Rehabilitation Medicine. 2013; 37(4):461. [DOI:10.5535/arm.2013.37.4.461] [PMID] [PMCID]
25.Manganotti P, Amelio E. Long-term effect of shock wave therapy on upper limb hypertonia in patients affected by stroke. Stroke. 2005; 36(9):1967-71. [DOI:10.1161/01.STR.0000177880.06663.5c] [PMID]
26.Amelio E, Manganotti P. Effect of shock wave stimulation on hypertonic plantar flexor muscles in patients with cerebral palsy: A placebo-controlled study. Journal of Rehabilitation Medicine. 2010; 42(4):339-43. [DOI:10.2340/16501977-0522] [PMID]
27.Li TY, Chang CY, Chou YC, Chen LC, Chu HY, Chiang SL, et al. Effect of radial shock wave therapy on spasticity of the upper limb in patients with chronic stroke: A prospective, randomized, single blind, controlled trial. Medicine. 2016; 95(18):e3544. [DOI:10.1097/MD.0000000000003544] [PMID] [PMCID]
28.Mao LF, Zheng QQ. The characteristics, methods of meta-analysis and its applications. Chinese Journal of Applied Psychology. 2005; 11(4):354-9. https://en.cnki.com.cn/Article_en/CJFDTotal-YXNX200504011.htm
29.Lee JY, Kim SN, Lee IS, Jung H, Lee KS, Koh SE. Effects of extracorporeal shock wave therapy on spasticity in patients after brain injury: A meta-analysis. Journal of Physical Therapy Science. 2014; 26(10):1641-7. [DOI:10.1589/jpts.26.1641] [PMID] [PMCID]
30.Guo P, Gao F, Zhao T, Sun W, Wang B, Li Z. Positive effects of extracorporeal shock wave therapy on spasticity in poststroke patients: a meta-analysis. Journal of Stroke and Cerebrovascular Diseases. 2017; 26(11):2470-6. [DOI:10.1016/j.jstrokecerebrovasdis.2017.08.019] [PMID]
31.Xiang J, Wang W, Jiang W, Qian Q. Effects of extracorporeal shock wave therapy on spasticity in post-stroke patients: A systematic review and meta-analysis of randomized controlled trials. Journal of Rehabilitation Medicine. 2018; 50(10):852-9. [DOI:10.2340/16501977-2385] [PMID]
32.Radinmehr H, Nakhostin Ansari N, Naghdi S, Olyaei G, Tabatabaei A. Effects of one session radial extracorporeal shockwave therapy on post-stroke plantarflexor spasticity: A single-blind clinical trial. Disability and Rehabilitation. 2017; 39(5):483-90. [DOI:10.3109/09638288.2016.1148785] [PMID]
33.Sohn MK, Cho KH, Kim YJ, Hwang SL. Spasticity and electrophysiologic changes after Extracorporeal Shock Wave Therapy on gastrocnemius. Annals of Rehabilitation Medicine. 2011; 35(5):599. [DOI:10.5535/arm.2011.35.5.599] [PMID] [PMCID]
34.Gawad HAA, Mohammed A, Karim A. Shock wave therapy for spastic plantar flexor muscles in hemiplegic cerebral palsy children. Egyptian Journal of Medical Human Genetics. 2015; 16(3):269-75. [DOI:10.1016/j.ejmhg.2014.12.007]
35.Marinelli L, Mori L, Solaro C, Uccelli A, Pelosin E, Curra A, et al. Effect of radial shock wave therapy on pain and muscle hypertonia: A double-blind study in patients with multiple sclerosis. Multiple Sclerosis Journal. 2015; 21(5):622-9. [DOI:10.1177/1352458514549566] [PMID]
36.Hiersemenzel LP, Curt A, Dietz V. From spinal shock to spasticity: Neuronal adaptations to a spinal cord injury. Neurology. 2000; 54(8):1574-82. [DOI:10.1212/WNL.54.8.1574] [PMID]
37.Bae HS, Lee JM, Lee KH. [The effects of extracorporeal shock wave therapy on spasticity in chronic stroke patients (Korean)]. Journal of Korean Academy of Rehabilitation Medicine. 2010; 34(6):663-9. https://kmbase.medric.or.kr/KMID/0361420100340060663
38.Santamato A, Francesca Micello M, Panza F, Fortunato F, Logroscino G, Picelli A, et al. Extracorporeal shock wave therapy for the treatment of poststroke plantar-flexor muscles spasticity: a prospective open-label study. Topics in Stroke Rehabilitation. 2014; 21(sup1):S17-S24. [DOI:10.1310/tsr21S1-S17] [PMID]
39.Fouda KZ, Sharaf MA. Efficacy of radial shock wave therapy on spasticity in stroke patients. International Journal of Health and Rehabilitation Sciences. 2015; 4(1):19-26. [DOI:10.5455/ijhrs.000000072]
40.Dymarek R, Taradaj J, Rosińczuk J. Extracorporeal shock wave stimulation as alternative treatment modality for wrist and fingers spasticity in poststroke patients: A prospective, open-label, preliminary clinical trial. Evidence-Based Complementary and Alternative Medicine. 2016; 2016:10 [DOI:10.1155/2016/4648101] [PMID] [PMCID]
1.Katz RT, Rymer WZ. Spastic hypertonia: Mechanisms and measurement. Archives of Physical Medicine and Rehabilitation. 1989; 70(2):144-55. [DOI:10.5555/uri:pii:0003999389901342]
2.Bar-On L, Molenaers G, Aertbeliën E, Van Campenhout A, Feys H, Nuttin B, et al. Spasticity and its contribution to hypertonia in cerebral palsy. BioMed Research International. 2015. [DOI:10.1155/2015/317047] [PMID] [PMCID]
3.Katozian L, Tahan N, MohseniBandpei MA, JamBarsang S. Spasticity following stroke: A systematic review and meta-analysis. Journal of Mazandaran University of Medical Sciences. 2015; 25(123):230-45. https://www.researchgate.net/profile/Mohammad-Mohseni-Bandpei/publication/280444247_Motor_Learning_and_Movement_Performance_Aged_versus_Younger_Adults/links/55b6317208aec0e5f436ec17/Motor-Learning-and-Movement-Performance-Aged-versus-Younger-Adults.pdf
4.Rizzo MA, Hadjimichael OC, Preiningerova J, Vollmer TL. Prevalence and treatment of spasticity reported by Multiple Sclerosis Patients. Multiple Sclerosis Journal. 2004; 10(5):589-95. [DOI:10.1191/1352458504ms1085oa] [PMID]
5.Adams MM, Hicks AL. Spasticity after spinal cord injury. Spinal cord. 2005; 43(10):577-86. [DOI:10.1038/sj.sc.3101757] [PMID]
6.Mukherjee A, Chakravarty A. Spasticity mechanisms–for the clinician. Frontiers in Neurology. 2010; 1:149. [DOI:10.3389/fneur.2010.00149] [PMID] [PMCID]
7.O’dwyer N, Ada L, Neilson P. Spasticity and muscle contracture following stroke. Brain. 1996; 119(5):1737-49. [DOI:10.1093/brain/119.5.1737] [PMID]
8.Goldstein EM. Spasticity management: an overview. Journal of Child Neurology. 2001; 16(1):16-23. [DOI:10.1177/088307380101600104] [PMID]
9.Azimpour D, Tahan N. [The effect of three sessions shock wave therapy on spasticity and range of motion of lower limb in stroke patients (Persian)]. Tehran University Medical Journal TUMS Publications. 2019; 77(4):234-9. http://tumj.tums.ac.ir/article-1-9767-en.html
10.Cabanas-Valdés R, Calvo-Sanz J, Urrùtia G, Serra-Llobet P, Pérez-Bellmunt A, Germán-Romero A. The effectiveness of extracorporeal shock wave therapy to reduce lower limb spasticity in stroke patients: A systematic review and meta-analysis. Topics in Stroke Rehabilitation. 2020; 27(2):137-57. [DOI:10.1080/10749357.2019.1654242] [PMID]
11.Ogden JA, Tóth-Kischkat A, Schultheiss R. Principles of shock wave therapy. Clinical Orthopaedics and Related Research. 2001; 387:8-17. [DOI:10.1097/00003086-200106000-00003] [PMID]
12.Wang CJ. An overview of shock wave therapy in musculoskeletal disorders. Chang Gung Medical Journal. 2003; 26(4):220-32. http://cgmj.cgu.edu.tw/2604/260400.pdf
13.Romeo P, Lavanga V, Pagani D, Sansone V. Extracorporeal shock wave therapy in musculoskeletal disorders: a review. Medical Principles and Practice. 2014; 23(1):7-13. https://www.karger.com/Article/Abstract/355472
14.Takahashi N, Ohtori S, Saisu T, Moriya H, Wada Y. Second application of low-energy shock waves has a cumulative effect on free nerve endings. Clinical Orthopaedics and Related Research (1976-2007). 2006; 443:315-9. [DOI:10.1097/01.blo.0000188064.56091.a7] [PMID]
15.Kenmoku T, Ochiai N, Ohtori S, Saisu T, Sasho T, Nakagawa K, et al. Degeneration and recovery of the neuromuscular junction after application of extracorporeal shock wave therapy. Journal of Orthopaedic Research. 2012; 30(10):1660-5. [DOI:10.1002/jor.22111] [PMID]
16.Poursaeed F, Tahan N. Assessment of spasticity in patients with stroke (systematic review of literature). Journal of Rehabilitation Medicine. 2016; 5(1):190-208. [DOI:10.22037/JRM.2016.1100265]
17.Voerman GE, Gregorič M, Hermens HJ. Neurophysiological methods for the assessment of spasticity: The Hoffmann reflex, the tendon reflex, and the stretch reflex. Disability and Rehabilitation. 2005; 27(1-2):33-68. [DOI:10.1080/09638280400014600] [PMID]
18.Rekand T. Clinical assessment and management of spasticity: A review. Acta Neurologica Scandinavica. 2010; 122(s190):62-6. [DOI:10.1111/j.1600-0404.2010.01378.x] [PMID]
19.Lee CH, Lee SH, Yoo JI, Lee SU. Ultrasonographic evaluation for the effect of extracorporeal shock wave therapy on gastrocnemius muscle spasticity in patients with chronic stroke. PM & R. 2019; 11(4):363-71. [DOI:10.1016/j.pmrj.2018.08.379] [PMID]
20.Yoo SD, Kim HS, Jung PK. The effect of shock wave therapy on upper limb spasticityin the patients with stroke. Journal of Korean Academy of Rehabilitation Medicine. 2008; 32(4):406-10. https://www.koreamed.org/SearchBasic.php?RID=2325131
21.Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JP, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. Journal of Clinical Epidemiology. 2009; 62(10):e1-e34. [DOI:10.1016/j.jclinepi.2009.06.006] [PMID]
22.Subramanian SK, Caramba SM, Hernandez OL, Morgan QT, Cross MK, Hirschhauser CS. Is the Downs and Black scale a better tool to appraise the quality of the studies using virtual rehabilitation for post-stroke upper limb rehabilitation? Paper presentetd at: 2019 International Conference on Virtual Rehabilitation (ICVR). 2019 July 21; Tel Aviv, Israel. [DOI:10.1109/ICVR46560.2019.8994724]
23.Wang T, Du L, Shan L, Dong H, Feng J, Kiessling MC, et al. A prospective case-control study of radial extracorporeal shock wave therapy for spastic plantar flexor muscles in very young children with cerebral palsy. Medicine. 2016; 95(19):e3649. [DOI:10.1097/MD.0000000000003649] [PMID] [PMCID]
24.Moon SW, Kim JH, Jung MJ, Son S, Lee JH, Shin H, et al. The effect of extracorporeal shock wave therapy on lower limb spasticity in subacute stroke patients. Annals of Rehabilitation Medicine. 2013; 37(4):461. [DOI:10.5535/arm.2013.37.4.461] [PMID] [PMCID]
25.Manganotti P, Amelio E. Long-term effect of shock wave therapy on upper limb hypertonia in patients affected by stroke. Stroke. 2005; 36(9):1967-71. [DOI:10.1161/01.STR.0000177880.06663.5c] [PMID]
26.Amelio E, Manganotti P. Effect of shock wave stimulation on hypertonic plantar flexor muscles in patients with cerebral palsy: A placebo-controlled study. Journal of Rehabilitation Medicine. 2010; 42(4):339-43. [DOI:10.2340/16501977-0522] [PMID]
27.Li TY, Chang CY, Chou YC, Chen LC, Chu HY, Chiang SL, et al. Effect of radial shock wave therapy on spasticity of the upper limb in patients with chronic stroke: A prospective, randomized, single blind, controlled trial. Medicine. 2016; 95(18):e3544. [DOI:10.1097/MD.0000000000003544] [PMID] [PMCID]
28.Mao LF, Zheng QQ. The characteristics, methods of meta-analysis and its applications. Chinese Journal of Applied Psychology. 2005; 11(4):354-9. https://en.cnki.com.cn/Article_en/CJFDTotal-YXNX200504011.htm
29.Lee JY, Kim SN, Lee IS, Jung H, Lee KS, Koh SE. Effects of extracorporeal shock wave therapy on spasticity in patients after brain injury: A meta-analysis. Journal of Physical Therapy Science. 2014; 26(10):1641-7. [DOI:10.1589/jpts.26.1641] [PMID] [PMCID]
30.Guo P, Gao F, Zhao T, Sun W, Wang B, Li Z. Positive effects of extracorporeal shock wave therapy on spasticity in poststroke patients: a meta-analysis. Journal of Stroke and Cerebrovascular Diseases. 2017; 26(11):2470-6. [DOI:10.1016/j.jstrokecerebrovasdis.2017.08.019] [PMID]
31.Xiang J, Wang W, Jiang W, Qian Q. Effects of extracorporeal shock wave therapy on spasticity in post-stroke patients: A systematic review and meta-analysis of randomized controlled trials. Journal of Rehabilitation Medicine. 2018; 50(10):852-9. [DOI:10.2340/16501977-2385] [PMID]
32.Radinmehr H, Nakhostin Ansari N, Naghdi S, Olyaei G, Tabatabaei A. Effects of one session radial extracorporeal shockwave therapy on post-stroke plantarflexor spasticity: A single-blind clinical trial. Disability and Rehabilitation. 2017; 39(5):483-90. [DOI:10.3109/09638288.2016.1148785] [PMID]
33.Sohn MK, Cho KH, Kim YJ, Hwang SL. Spasticity and electrophysiologic changes after Extracorporeal Shock Wave Therapy on gastrocnemius. Annals of Rehabilitation Medicine. 2011; 35(5):599. [DOI:10.5535/arm.2011.35.5.599] [PMID] [PMCID]
34.Gawad HAA, Mohammed A, Karim A. Shock wave therapy for spastic plantar flexor muscles in hemiplegic cerebral palsy children. Egyptian Journal of Medical Human Genetics. 2015; 16(3):269-75. [DOI:10.1016/j.ejmhg.2014.12.007]
35.Marinelli L, Mori L, Solaro C, Uccelli A, Pelosin E, Curra A, et al. Effect of radial shock wave therapy on pain and muscle hypertonia: A double-blind study in patients with multiple sclerosis. Multiple Sclerosis Journal. 2015; 21(5):622-9. [DOI:10.1177/1352458514549566] [PMID]
36.Hiersemenzel LP, Curt A, Dietz V. From spinal shock to spasticity: Neuronal adaptations to a spinal cord injury. Neurology. 2000; 54(8):1574-82. [DOI:10.1212/WNL.54.8.1574] [PMID]
37.Bae HS, Lee JM, Lee KH. [The effects of extracorporeal shock wave therapy on spasticity in chronic stroke patients (Korean)]. Journal of Korean Academy of Rehabilitation Medicine. 2010; 34(6):663-9. https://kmbase.medric.or.kr/KMID/0361420100340060663
38.Santamato A, Francesca Micello M, Panza F, Fortunato F, Logroscino G, Picelli A, et al. Extracorporeal shock wave therapy for the treatment of poststroke plantar-flexor muscles spasticity: a prospective open-label study. Topics in Stroke Rehabilitation. 2014; 21(sup1):S17-S24. [DOI:10.1310/tsr21S1-S17] [PMID]
39.Fouda KZ, Sharaf MA. Efficacy of radial shock wave therapy on spasticity in stroke patients. International Journal of Health and Rehabilitation Sciences. 2015; 4(1):19-26. [DOI:10.5455/ijhrs.000000072]
40.Dymarek R, Taradaj J, Rosińczuk J. Extracorporeal shock wave stimulation as alternative treatment modality for wrist and fingers spasticity in poststroke patients: A prospective, open-label, preliminary clinical trial. Evidence-Based Complementary and Alternative Medicine. 2016; 2016:10 [DOI:10.1155/2016/4648101] [PMID] [PMCID]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |








.jpg)
.jpg)
.jpg)
.jpg)
