دوره 21، شماره 3 - ( پاییز 1399 )
دوره، شماره، فصل و سال، شماره مسلسل |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Niajalili M, Sedaghat M, Reazasoltani A, Akbarzade Baghban A R, Naimi S S. Effect of Capacitive Tecar Therapy on Foot Pain and Tactile Sensation in Patients with Type 2 Diabetes. jrehab 2020; 21 (3) :304-319
URL: http://rehabilitationj.uswr.ac.ir/article-1-2721-fa.html
URL: http://rehabilitationj.uswr.ac.ir/article-1-2721-fa.html
نیاءجلیلی مریم، صداقت مقداد، رضاسلطانی اصغر، اکبرزاده باغبان علیرضا، نعیمی صدیقه السادات. تاثیر تکارتراپی بر درد و اختلال حس لمس پای بیماران دیابتیک نوع دو. مجله توانبخشی. 1399; 21 (3) :304-319
URL: http://rehabilitationj.uswr.ac.ir/article-1-2721-fa.html
1- گروه فیزیوتراپی، دانشکده توانبخشی، دانشگاه علومپزشکی شهید بهشتی، تهران، ایران.
2- گروه پزشکی داخلی، دانشکده پزشکی، دانشگاه علومپزشکی شهید بهشتی تهران، ایران.
3- گروه آمار زیستی، مرکز تحقیقات فیزیوتراپی، دانشکده پیراپزشکی، دانشگاه علومپزشکی شهید بهشتی، تهران، ایران.
4- گروه فیزیوتراپی، دانشکده توانبخشی، دانشگاه علومپزشکی شهید بهشتی، تهران، ایران. ،naimi.se@sbmu.ac.ir
2- گروه پزشکی داخلی، دانشکده پزشکی، دانشگاه علومپزشکی شهید بهشتی تهران، ایران.
3- گروه آمار زیستی، مرکز تحقیقات فیزیوتراپی، دانشکده پیراپزشکی، دانشگاه علومپزشکی شهید بهشتی، تهران، ایران.
4- گروه فیزیوتراپی، دانشکده توانبخشی، دانشگاه علومپزشکی شهید بهشتی، تهران، ایران. ،
متن کامل [PDF 5075 kb]
(2351 دریافت)
| چکیده (HTML) (5804 مشاهده)
ابزار گردآوری دادهها
همه بیماران تحت شیوه یکسان و توسط یک فرد از شروع تا پایان ده جلسه درمان مورد ارزیابی قرار گرفتند. قبل از شروع درمان، اطلاعات جمعیتشناختی بیمار جهت بررسی دقیقتر ثبت شد. برای ارزیابی متغیرهای مورد بحث بیماران از ابزارهایی که در ادامه ذکر شده است، استفاده شد.
مونوفیلامان سیمز وینشتاین 5/07/10 گرمی برای بررسی حس لمس کف پای بیماران دیابتیک استفاده شد (تصویر شماره 1). جهت ارزیابی، بیمارها با چشم بسته به پشت دراز کشیده و فیلامان بر نقاط رو و پشت پای آنها، با فشاری در حد خم شدن سر آن و در مدتی کمتر از یک ثانیه قرار گرفت و افراد تعداد نقاط حسکرده را گزارش کردند. اگر از ده نقطه اعمال مونوفیلامان، فرد قادر به تشخیص هشت نقطه یا بیشتر باشد، حس لمس کف پای وی طبیعی است. در صورتی که فرد یک تا هفت نقطه را تشخیص دهد به معنای کاهش حس لمس و اگر نقطهای را تشخیص ندهد به معنای عدم وجود این حس است [27].
برای اندازهگیری میزان درد پاهای بیمار از مقیاس 10سانتیمتری آنالوگ بینایی استفاده شد. این مقیاس یک روش ذهنی برای ارزیابی ناراحتیهای حسی نظیر درد نوروپاتی دیابتیک پاست که شامل یک خط مستقیم بوده که از صفر تا 10 عددگذاری شده است. یک انتهای آن عدد صفر، به معنای بدون درد و انتهای دیگر، عدد 10، به معنای بیشترین ناراحتی و درد در فرد است. از بیماران خواسته شد دردی را که در پای خود در حالت استراحت احساس میکردند روی نقطهای که به بهترین نحو، شدت درد آنها را نشان میداد، علامتگذاری کنند [28].
روشهای درمان
روند درمان این مطالعه در دو مرحله با اشعه مادون قرمز و تکار خازنی در دو گروه آزمایش و کنترل، طی ده جلسه (سه بار در هفته به مدت چهار هفته)، در آزمایشگاه بیومکانیک دانشکده توانبخشی دانشگاه علومپزشکی شهید بهشتی انجام شد.
1. گروه آزمایش: در این گروه 12 بیمار دیابتیک با 24 پا با علائم نوروپاتی، تحت درمان با اشعه مادون قرمز و تکار واقعی قرار گرفتند.
2. گروه کنترل: در این گروه 12 بیمار دیابتیک با 24 پا با علائم نوروپاتی تحت درمان با اشعه مادون قرمز و تکار شم قرار گرفتند.
در ابتدای روند مداخله، پاهای بیماران تحت درمان با اشعه مادون قرمز قرار گرفتند. آرتور سوسیزلوکی و همکاران اثر کوتاه مدت این مدالیتی را بر بهبود درد و حس لمس کف پای بیماران با نوروپاتی دیابتیک تایید نمودند. این محققان طی مطالعه خود، اشعه مادون قرمز با طول موج 870 نانومتر و دانسیته انرژی 1/8 ژول بر سانتی متر مربع بر دقیقه را به مدت 7 دقیقه بر هر سطح پا اعمال کردند [29].
در پژوهش حاضر، اشعه مادون قرمز با طول موج 890 نانومتر و دانسیته 1/3 ژول بر سانتیمتر مربع بر دقیقه استفاده شد. بیماران یکبار پشت به اشعه و بار دیگر رو به آن به پهلو دراز کشیده و هر سطح دورسال، پلنتار، مدیال و لترال پای آنها با فاصله 80 تا 90 سانتیمتر به مدت 30 دقیقه تحت درمان با این اشعه قرارگرفت (تصویر شماره 2).
در مرحله بعد، درمان به کمک دستگاه تکار از نوع خازنی با مدل TEKRA XCRT, New Ageساخت کشور ایتالیا انجام شد (تصویر شماره 3). این دستگاه بر اساس قوانین فیزیکی دارای دو الکترود فعال و غیرفعال جداگانه متصل به ژنراتور الکتریکی، برای هر دو روش خازنی و مقاومتی است که ولتاژ را بین دو الکترود برقرار مینماید [22]. در پژوهش حاضر به دلیل بررسی آسیب اعصاب کف پای بیماران دیابیتک، از تکار خازنی جهت درمان استفاده شد که این روش باعث افزایش خونرسانی، گرمای موضعی و انبساط عروق بافتی میشود [21].
اصول پایه این پژوهش بر اساس مطالعات گذشته تکارتراپی است [24]، اما به دلیل عدم بررسی اثر آن بر آسیبهای سیستم عصبی، با انجام مطالعه پایلوت روش زیر نتیجهبخش بوده است.
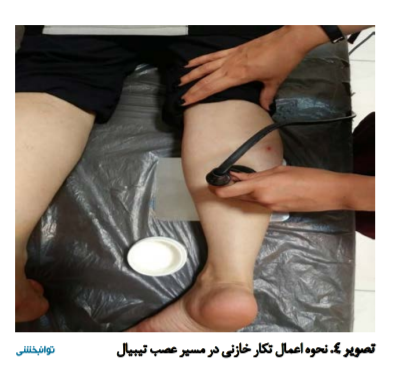
در این روش، بیمار به شکم میخوابید و درمان تکار خازنی در دو طرف مسیر سطحی شدن عصب تیبیال با شدت کمتر از 50 درصد و به صورت پالس (بسته به تحمل بیماران دیابتیک) انجام میشد. به این صورت که ژل دستگاه بر سطح دو الکترود فعال، غیرفعال و پوست بیمار آغشته شده و الکترود غیرفعال آن بر سطح قدامی ساق قرار میگرفت و الکترود فعال آن در مسیر عصب تیبیال هر دو پای بیماران از ناحیه پوپلیته تا قوزک داخلی به طور مداوم به مدت 20 دقیقه حرکت داده میشد (تصویر شماره 4).
بنابراین بین گروههای بررسیشده در متغیرهای پژوهش در مرحله پیشآزمون تفاوتی وجود نداشت. به منظور بررسی پیشفرض همگنی واریانسها از آزمون لون استفاده شد (جدول شماره 3). با توجه به اینکه مقدار F معنیدار نیست (p>0/05).
یافتههای مربوط به نمره درد حاصل از مقیاس VAS
ابتدا میزان نمره درد بیماران دو گروه، به کمک آزمون تی مستقل مقایسه شد که با 0/56=P اختلاف در دو گروه آزمایش و کنترل وجود نداشت (جدول شماره 3).

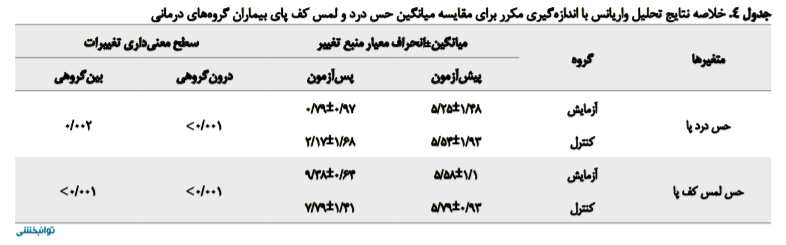
بر اساس جدول شماره 4 مشاهده میشود که میانگین میزان درد، پس از درمان در دو گروه، کاهش معنیدار آماری داشته است (0/001>P).
همچنین تفاوت بین میانگین دادههای دو گروه معنیدار بود؛ یعنی بیماران گروه درمان درمجموع درد کمتری را نسبت به گروه کنترل تجربه کردند (0/002=P). به بیان دیگر، هر دو روش درمانی در کاهش درد بیماران دو گروه آزمایش و کنترل تأثیر داشته است، اما ترکیب اشعه مادون قرمز و تکار خازنی در کاهش درد موفقتر بوده است. به این صورت که میانگین نمره حاصل از مقیاس VAS در دو گروه کنترل و آزمایش به ترتیب، قبل از اعمال مداخله 1/93±5/54 و 1/48±5/25 بوده و پس از اعمال مداخله به 1/60±2/17 و 0/97±0/79 رسیده است.
یافتههای مربوط به نمره حس لمس کف پای حاصل از ابزار مونوفیلامان
بر اساس جدول شماره 3 ابتدا میزان نمره حس لمس کف پای بیماران دو گروه به کمک آزمون تی مستقل مقایسه شد که با 0/482=P در دو گروه آزمایش و کنترل اختلافی وجود نداشت. جدول شماره 4 نشان میدهد که میانگین نمره این حس بعد از ده جلسه درمانی در گروهها افزایش معنیدار آماری داشته است (0/001>P). همچنین وجود تفاوت معنیدار بین دو گروه، بیانگر بهبود بیشتر حس لمس کف پای بیماران گروه آزمایش نسبت به گروه کنترل است (0/001>P). به بیان دیگر، هر دو روش درمانی در بهبود نمره ابزار مونوفیلامان، در دو گروه آزمایش و کنترل تأثیر داشتهاند، اما ترکیب اشعه مادون قرمز و تکار خازنی در بهبود این متغیر موفقتر بودهاست. به این صورت که میانگین نمره حاصل از ابزار مونوفیلامان در دو گروه کنترل و آزمایش به ترتیب، قبل از اعمال مداخله 0/93±5/79 و 1/1±5/58بوده و پس از اعمال مداخله به 1/14±7/79 و 0/64±9/38 رسیده است.
بحث
هدف پژوهش حاضر، بررسی تأثیر تکار خازنی بر علائم ناشی از نوروپاتی محیطی بیماران دیابتیک نوع دو بود. یافتههای پژوهش نشان میدهند ترکیب تکار خازنی و اشعه مادون قرمز بر بهبود علائم نوروپاتی محیطی این بیماران، تأثیر مثبت و معنیداری دارد. با استفاده از این روش جدید، در میانگین متغیر درد و حس لمس کف پا نسبت به تغییرات درمان رایج، بهبودی قابل توجهی حاصل شد. مطالعه منتشرشدهای که تأثیر تکار را بر علائم نوروپاتی محیطی بیماران دیابتیک بررسی نماید، یافت نشد، اما بررسی مطالعات انجامشده در زمینه تأثیر تکارتراپی بر ضایعات عضلانی اسکلتی بیانگر بهبود درد و عملکرد بافتهای آسیبدیده است [30]. این در حالی است که بسیاری از پژوهشهای انجامشده درباره امواج الکترومغناطیسی با فرکانس پایین، تأثیر امواج الکترومغناطیسی را بر متغیرهای مختلف بیماران دیابتیک تأیید کرده و برخی آن را بدون تأثیر درمانی ذکر کردهاند.
یافته پژوهش حاضر نشان داد استفاده از تکار خازنی طی ده جلسه به کاهش درد بیشتر در پای بیماران در گروه آزمایش در مقایسه با گروه کنترل منجر شده است. درد نوروپاتی محیطی از مقاومترین انواع درد نسبت به درمان است [31]. بر اساس مطالعات تقریباً بیش از نیمی از بیماران با علائم نوروپاتی دیابتیک که تحت درمان قرار گرفتند، تسکین درد را تجربه نمیکنند [32].
یافته یکی از پژوهشها نشان داد با استفاده از دستگاه مولد امواج الکترومغناطیسی با فرکانس مدوله یک تا 1000 هرتز طی ده جلسه و تأکید بر افزایش خونرسانی و فاکتور رشد اندوتلیال عروقی بر اعصاب اندام تحتانی بیماران با نوروپاتی دیابیتک، میتوان درد و آستانه حس سرمای آن را بهبود بخشید [14]. همچنین میتوان با استفاده از ترکیب امواج الکترومغناطیسی با فرکانس 50 هرتز و تمریندرمانی و با تحریک بیشتر سیستم عصبی عروقی بافتها، درد پای بیماران را کاهش داد و موجب بهبود سرعت هدایت عصب حسی آنها شد [15]. در حالی که پژوهشی دیگر نشان داده است امواج الکترومغناطیسی پالسدار با فرکانس 50 هرتز و شدت 1800 گاوس در بهبود درد پای بیماران مؤثر نیستند. شدت کم جریان کاربردی، علت عدم تأثیرگذاری این امواج بیان شده است [19].
در تبیین یافتههای این پژوهش میتوان اظهار کرد که ترکیب تکار خازنی در مسیر عصب تیبیال و اشعه مادون قرمز، گیرنده حس درد پای بیماران دیابتیک را تحت تأثیر قرار داده و با آزادسازی اندورفینها و افزایش گرمای بافتی موجب کاهش درد پای آنها شده است.
یافته دیگر این پژوهش، حاکی از بهبود قابل توجه حس لمس کف پای بیماران دیابتیک در گروه آزمایش است. نوروپاتی محیطی به دنبال کاهش حس پاها شیوع زخم پای دیابتیک را افزایش میدهد. از اینرو درمان این اختلال اهمیت فراوانی دارد [6]. یافتهی اخیر با نتایج پژوهش استین و همکاران در سال 2013 مبنی براعمال امواج الکترومغناطیس پالس دار با فرکانس مدوله بر اندام تحتانی بیماران دیابتیک همخوانی دارد. براساس نتایج پژوهش این محققان، امواج الکترومغناطیسی با فعال سازی مستقیم و غیر مستقیم فیبرهای آ دلتا و سی به سمت دیستال آکسون ها، باعث افزایش حس لمس کف پای بیماران می-شود [33]. اما در پژوهش دیگر نشان داده شده است که با وجود استفاده از امواج الکترومغناطیس با فرکانس مدوله 1تا 1000 هرتز بهبودی قابل توجهی در حس لمس کف پا دیده نشد. زیرا تنها بیماران با اختلال خفیف در حس لمس کف پاها، تحت درمان قرار گرفتند [14].
با بررسی یافتههای پژوهش میتوان اظهار کرد که اعمال تکار خازنی در کنار درمان رایج اشعه مادون قرمز با تأکید بر بهبود عملکرد سیستم متابولیسم و عصبی عروقی به افزایش حس لمس در کف پای آنان منجر شده است. به دلیل وجود تناقضات در نتایج مطالعات بررسی میزان تأثیر تکارتراپی (امواج الکترومغناطیسی با فرکانس بالا) مورد بحث قرار گرفته است.
در مطالعه حاضر طی ده جلسه درمانی (چهار هفته) از تکار خازنی مدل TEKRA XCRT, New Age در کنار درمان رایج اشعه مادون قرمز با طول موج 890 نانومتر، به منظور بررسی اثر درمانی آن بر عملکرد اعصاب اندام تحتانی بیماران دیابتیک استفاده شد. بدین منظور در گروه آزمایش، ابتدا سطح پای بیماران به مدت 30 دقیقه و با فاصله 80 تا 90 سانتیمتر، تحت درمان با اشعه مادون قرمز قرار گرفت و سپس الکترود فعال تکار خازنی با شدت کمتر از 50 درصد به مدت 20 دقیقه در مسیر عصب تیبیال از بالا تا پایین حرکت داده شد. اما در گروه کنترل، شدت دستگاه تکار روشن، صفر بود. نتایج مطالعه حاضر بعد از اتمام جلسات درمانی نشان داد تکار خازنی با وجود ایجاد گرمای عمقی و بهبود عملکرد اعصاب بافتهای آسیبدیده، در کنار درمان رایج، باعث بهبود قابل توجه علائم نوروپاتی بیماران دیابتیک نسبت به درمان رایج تنها شده است. به بیان دیگر استفاده از این روش جدید باعث شده است افراد دیابتیک با علائم نوروپاتی محیطی، کاهش درد و بهبود حس لمس کف پای بهتری را تجربه نمایند.
نتیجهگیری
ترکیب بهکاربرده تکار خازنی با داشتن خاصیت گرمایی موضعی و بهبود جریان خون و اشعه مادون قرمز توانسته است به میزان قابل توجهی درد اندام تحتانی را کاهش دهد و حس لمس کف پای بیماران را بهبود بخشد. بر اساس این نتایج میتوان استفاده از این شیوه را به عنوان روش مؤثر در بهبود علائم نوروپاتی محیطی مرتبط با دیابت نوع دو در کنار سایر مدالیتیهای فیزیوتراپی پیشنهاد داد. استفاده از این روش به مدت چهار هفته و طی ده جلسه درمانی یکی از محدودیتهای تحقیق بود که اگر دوره درمان آن افزایش مییافت، نتایج دقیقتری حاصل میشد. از محدودیتهای دیگر آن میتوان به بررسی کوتاهمدت اثر درمان و یکسوکور بودن مطالعه اشاره نمود که این امر میتواند تا حدودی بر نتایج حاصل از آن اثر بگذارد. به علاوه در کشور ما به علت محدودیت پوشش بیمهای جهت تأمین هزینههای مالی این دستگاه، امکان استفاده تمام بیماران دیابتیک از آن فراهم نمیشود. از طرف دیگر مطالعهای در دنیا درباره بررسی اثر تکارتراپی بر علائم نوروپاتی دیابتیک وجود ندارد. درنتیجه امکان ارزیابی و بررسی دقیق درباره نحوه عملکرد این مدالیتی فراهم نیست. محققان این مطالعه انجام مطالعات بیشتری را با پیگیری طولانیمدت در زمینه بررسی تأثیر تکارتراپی بر علائم حسی ناشی از نوروپاتی دیابتیک پیشنهاد میکنند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این طرح در کمیته اخلاق دانشگاه علومپزشکی شهید بهشتی با کد IR.SBMU.RETECH.REC.1397.713 به تصویب رسید همچنین این کارآزمایی در پایگاه ثبت کارآزماییهای بالینی ایران با کد IRCT20190726044337N1 به ثبت رسیده است.
حامی مالی
این مقاله برگرفته از پایاننامه کارشناسی ارشد نویسنده اول خانم مریم نیاءجلیلی،گروه فیزیوتراپی، دانشگاه علومپزشکی شهید بهشتی است.
مشارکت نویسندگان
مفهومسازی: اصغر رضاسلطانی؛ روششناسی: اصغر رضاسلطانی، صدیقه السادات نعیمی، مقداد صداقت، علیرضا اکبرزاده باغبان، مریم نیاءجلیلی؛ تحقیق و بررسی: مریم نیاءجلیلی، اصغر رضاسلطانی، صدیقه السادات نعیمی؛ ویراستاری و نهاییسازی: مریم نیاءجلیلی.
تعارض منافع
بنا بر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
متن کامل: (5323 مشاهده)
مقدمه
دیابت یکی از شایعترین اختلالات متابولیک است که به علت اختلال در متابولیسم کربوهیدراتها و نقص در تولید و عمل انسولین منجر به افزایش قند خون میشود [1]. در حال حاضر 405/6 میلیون بزرگسال مبتلا به دیابت هستند و تا سال 2030 تعداد این افراد به 510/8 میلیون نفر افزایش مییابد [2]. دیابت نوع دو شایعترین نوع دیابت است و 90-95 درصد انواع دیابت را شامل میشود [3]. کارشناسان سازمان جهانی سلامت، میزان شیوع دیابت نوع دو را در سال 2000 و 2025 به ترتیب 5/7 و 7/8 درصد برآورد کردهاند [4]. با توجه به اینکه تشخیص بالینی چهار تا هفت سال بعد از شروع دیابت اتفاق میافتد، عوارض تخریبی فراوانی بر ارگانهای بدن اعمال میشود [5].
نوروپاتی محیطی دیابتیک از شایعترین عوارض بیماری دیابت است [6] که 12 تا 50 درصد از افراد دیابتیک را تحت تأثیر قرار میدهد [7]. این عارضه مجموعهای از سندرمهای قابل تشخیص و غیر قابل تشخیص است که اختلالات متعددی را به همراه میآورد [8]. کاهش تدریجی عملکرد فیبرهای C بدون میلین و آ دلتای کوچک که القاکننده حس درد، دما و لمس هستند، به علت عوامل پاتولوژیک بیماری دیابت، از اختلالات مهم این عارضه است [9]. در ابتدا این اختلال از دیستال اندامها به سمت پروگزیمال ظاهر میشود و انتهای بزرگترین فیبرهای عصبی بدن را درگیر میکند؛ بنابراین اندام تحتانی بیماران دیابتیک بیشتر از سایر نواحی مستعد اختلالات حسی است. پس میتوان نتیجه گرفت که بین نوروپاتی دیابتیک با آکسونوپاتی پیشرونده دیستال ارتباطی وجود دارد [10]. با وجود مراقبتهای دارویی در کنترل قند خون و کاهش درد، بیماران دیابتیک قادر به تحمل عوارض ناشی از نوروپاتی نیستند [11].
درمان عوارض ناشی از نوروپاتی دیابتیک برای درمانگران بسیار دشوار است. درمانهای رایج عمدتاً علامتی هستند و موفقیت آنها کمتر از 40 تا 60 درصد است. مدالیتیهایی نظیر تحریکات الکتریکی، لیزردرمانی، اشعه مادون قرمز و امواج مغناطیسی جهت کنترل و بهبود علائم پیشنهاد شدهاند [12]. یکی از مداخلاتی که در کنترل روند نوروپاتی دیابتیک استفاده میشود، امواج الکترومغناطیسی با فرکانس پایین است که مطالعات متعددی اثر آن را بر بهبود عوارض ناشی از آن تأیید میکنند [13,14,15]. سیستم عصبی بنا به ماهیت خود فعالیت الکتریکی فراوانی دارد. با توجه به وابستگی ترشح هورمونها و نوروهورمونها به سیستم عصبی، امواج الکترومغناطیسی میتوانند بر بهبود عملکرد سیستم هورمونی و رشد و تمایز سلولی مؤثر واقع شوند [16، 17]. بررسی مطالعات انجامشده در زمینه اثر این امواج بر درد و حس لمس کف پای بیماران دیابتیک، نتایج مختلفی را به همراه داشته است. بوسی و همکاران [18] امواج الکترومغناطیسی با فرکانس یک تا 50 هرتز پالسدار را به دلیل فراخوانی تدریجی پتانسیل غشایی بافتهای آسیبدیده، در کاهش درد و بهبود حس لمس کف پای بیماران مؤثر دانستند. در حالی که مطالعات دیگر، عدم تأثیر امواج الکترومغناطیسی بر شاخص درد [19] و تأثیر اندک آن بر تغییرات حس لمس کف پا [14] را بیان کردهاند.
با وجود تناقضات در نتایج مطالعات، بررسی اثر امواج الکترومغناطیسی با فرکانس بالا بر علائم نوروپاتی دیابتیک مورد بحث قرار گرفته است. تکارتراپی نوعی از امواج الکترومغناطیسی با فرکانس بالا (0/3 تا 1/2 مگاهرتز) است [20] که با ایجاد گرمای عمقی در بافتها، سبب بهبود خونرسانی و آزادسازی بهتر هموگلوبین بافتی میشود [21]. این در حالی است که عملکرد دستگاه تکار از طریق دو روش خازنی و مقاومتی فراهم میشود که این روشها از طریق الکترودهای جداگانه و بر اساس مقاومت بافت مدنظر، اعمال میشوند. جهت اثرگذاری در بافتهای سطحی و با مقاومت کمنظیر عضلات و اعصاب، الکترود فعال سرامیکی و الکترود غیرفعال فلزی کاربرد داشته و برای بافتهای عمقی با مقاومت بالا نظیر استخوان، الکترودهای فلزی استفاده میشوند. در روش خازنی الکترودها در دو طرف بافت آسیبدیده قرار میگیرند، اما در روش مقاومتی جایگذاری الکترود فعال در مفصل مدنظر، اهمیت دارد [22]. امواج الکترومغناطیسی خازنی مقاومتی در بیست سال اخیر در موارد کلینیکی استفاده شده است، اما مطالعات اندکی درباره اثرات درمانی آن وجود دارد [23]. اکثر مطالعات در این زمینه،کاهش درد و بهبود عملکرد را در ضایعات عضلانی اسکلتی نظیر کمردرد [24]، تاندونوپاتی آشیل و تاندونیت پتلا [25] گزارش کردهاند. مکانیسمهای فیزیولوژیک احتمالی این مدالیتی، بازسازی سلولی به دنبال اکسیژنرسانی بهتر بافتی، افزایش سرعت متابولیسم و کاهش درد با آزادسازی اندورفینها بودهاند [26]. از آنجایی که اثر این مداخله بر علائم نوروپاتی بیماران دیابتیک بررسی نشده است، لذا هدف از انجام این مطالعه بررسی اثر تکار خازنی بر درد و اختلالات حس لمس کف پای این افراد بود.
روش بررسی
بیماران
پژوهش حاضر یک مطالعه کارآزمایی بالینی یکسوکور (بیماران) با طرح پیشآزمون و پسآزمون با گروه کنترل است که روی بیماران دیابتیک نوع دو مبتلا به نوروپاتی محیطی در سال 1398 انجام شد. نمونهگیری به روش غیرتصادفی ساده بود و شرکتکنندگان از بین مراجعهکنندگان درمانگاه دیابت بیمارستان امامحسین(ع) وابسته به دانشگاه علومپزشکی شهید بهشتی انتخاب شدند. سپس در آزمایشگاه بیومکانیک دانشکده توانبخشی دانشگاه علومپزشکی شهید بهشتی به صورت تصادفی در دو گروه آزمایش و کنترل مورد ارزیابی و درمان قرار گرفتند. با توجه به کمی بودن متغیرهای وابسته تحقیق و وجود دو گروه مستقل و به کمک معادله شماره 1، تعداد نهایی نمونهها با استفاده از مطالعه پایلوت به حجم 5 نفر در هر گروه، با احتمال خطای نوع اول 0/05 و توان آزمون 0/80 و احتمال ریزش، در هریک از گروههای آزمایش و کنترل 12 نفر ( 24 پا) تعیین شد و درمجموع 24 بیمار دیابتیک برای مطالعه انتخاب شدند.
معادله شماره 1
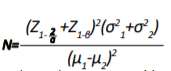
ملاکهای ورود به مطالعه شامل بیماران مرد و زن مبتلا به دیابت نوع دو، علائم نوروپاتی سطح 1 یا 2 در اندام تحتانی، سن بین 18 تا 78 سال، نمره درد 3 یا بیشتر بر اساس مقیاس آنالوگ بصری در ناحیه پاها، سابقه بیشتر از یک سال ابتلا به دیابت و سرعت هدایت عصب حرکتی تیبیال کمتر از 40 متر بر ثانیه و داشتن زندگی مستقل بود. ملاکهای خروج از مطالعه، مشکلات سیستماتیک عروق مرکزی و محیطی، اختلالات کلیوی، بارداری، داشتن اضطراب و استرس و عدم تمایل بیمار به ادامه همکاری در نظر گرفته شد.
دیابت یکی از شایعترین اختلالات متابولیک است که به علت اختلال در متابولیسم کربوهیدراتها و نقص در تولید و عمل انسولین منجر به افزایش قند خون میشود [1]. در حال حاضر 405/6 میلیون بزرگسال مبتلا به دیابت هستند و تا سال 2030 تعداد این افراد به 510/8 میلیون نفر افزایش مییابد [2]. دیابت نوع دو شایعترین نوع دیابت است و 90-95 درصد انواع دیابت را شامل میشود [3]. کارشناسان سازمان جهانی سلامت، میزان شیوع دیابت نوع دو را در سال 2000 و 2025 به ترتیب 5/7 و 7/8 درصد برآورد کردهاند [4]. با توجه به اینکه تشخیص بالینی چهار تا هفت سال بعد از شروع دیابت اتفاق میافتد، عوارض تخریبی فراوانی بر ارگانهای بدن اعمال میشود [5].
نوروپاتی محیطی دیابتیک از شایعترین عوارض بیماری دیابت است [6] که 12 تا 50 درصد از افراد دیابتیک را تحت تأثیر قرار میدهد [7]. این عارضه مجموعهای از سندرمهای قابل تشخیص و غیر قابل تشخیص است که اختلالات متعددی را به همراه میآورد [8]. کاهش تدریجی عملکرد فیبرهای C بدون میلین و آ دلتای کوچک که القاکننده حس درد، دما و لمس هستند، به علت عوامل پاتولوژیک بیماری دیابت، از اختلالات مهم این عارضه است [9]. در ابتدا این اختلال از دیستال اندامها به سمت پروگزیمال ظاهر میشود و انتهای بزرگترین فیبرهای عصبی بدن را درگیر میکند؛ بنابراین اندام تحتانی بیماران دیابتیک بیشتر از سایر نواحی مستعد اختلالات حسی است. پس میتوان نتیجه گرفت که بین نوروپاتی دیابتیک با آکسونوپاتی پیشرونده دیستال ارتباطی وجود دارد [10]. با وجود مراقبتهای دارویی در کنترل قند خون و کاهش درد، بیماران دیابتیک قادر به تحمل عوارض ناشی از نوروپاتی نیستند [11].
درمان عوارض ناشی از نوروپاتی دیابتیک برای درمانگران بسیار دشوار است. درمانهای رایج عمدتاً علامتی هستند و موفقیت آنها کمتر از 40 تا 60 درصد است. مدالیتیهایی نظیر تحریکات الکتریکی، لیزردرمانی، اشعه مادون قرمز و امواج مغناطیسی جهت کنترل و بهبود علائم پیشنهاد شدهاند [12]. یکی از مداخلاتی که در کنترل روند نوروپاتی دیابتیک استفاده میشود، امواج الکترومغناطیسی با فرکانس پایین است که مطالعات متعددی اثر آن را بر بهبود عوارض ناشی از آن تأیید میکنند [13,14,15]. سیستم عصبی بنا به ماهیت خود فعالیت الکتریکی فراوانی دارد. با توجه به وابستگی ترشح هورمونها و نوروهورمونها به سیستم عصبی، امواج الکترومغناطیسی میتوانند بر بهبود عملکرد سیستم هورمونی و رشد و تمایز سلولی مؤثر واقع شوند [16، 17]. بررسی مطالعات انجامشده در زمینه اثر این امواج بر درد و حس لمس کف پای بیماران دیابتیک، نتایج مختلفی را به همراه داشته است. بوسی و همکاران [18] امواج الکترومغناطیسی با فرکانس یک تا 50 هرتز پالسدار را به دلیل فراخوانی تدریجی پتانسیل غشایی بافتهای آسیبدیده، در کاهش درد و بهبود حس لمس کف پای بیماران مؤثر دانستند. در حالی که مطالعات دیگر، عدم تأثیر امواج الکترومغناطیسی بر شاخص درد [19] و تأثیر اندک آن بر تغییرات حس لمس کف پا [14] را بیان کردهاند.
با وجود تناقضات در نتایج مطالعات، بررسی اثر امواج الکترومغناطیسی با فرکانس بالا بر علائم نوروپاتی دیابتیک مورد بحث قرار گرفته است. تکارتراپی نوعی از امواج الکترومغناطیسی با فرکانس بالا (0/3 تا 1/2 مگاهرتز) است [20] که با ایجاد گرمای عمقی در بافتها، سبب بهبود خونرسانی و آزادسازی بهتر هموگلوبین بافتی میشود [21]. این در حالی است که عملکرد دستگاه تکار از طریق دو روش خازنی و مقاومتی فراهم میشود که این روشها از طریق الکترودهای جداگانه و بر اساس مقاومت بافت مدنظر، اعمال میشوند. جهت اثرگذاری در بافتهای سطحی و با مقاومت کمنظیر عضلات و اعصاب، الکترود فعال سرامیکی و الکترود غیرفعال فلزی کاربرد داشته و برای بافتهای عمقی با مقاومت بالا نظیر استخوان، الکترودهای فلزی استفاده میشوند. در روش خازنی الکترودها در دو طرف بافت آسیبدیده قرار میگیرند، اما در روش مقاومتی جایگذاری الکترود فعال در مفصل مدنظر، اهمیت دارد [22]. امواج الکترومغناطیسی خازنی مقاومتی در بیست سال اخیر در موارد کلینیکی استفاده شده است، اما مطالعات اندکی درباره اثرات درمانی آن وجود دارد [23]. اکثر مطالعات در این زمینه،کاهش درد و بهبود عملکرد را در ضایعات عضلانی اسکلتی نظیر کمردرد [24]، تاندونوپاتی آشیل و تاندونیت پتلا [25] گزارش کردهاند. مکانیسمهای فیزیولوژیک احتمالی این مدالیتی، بازسازی سلولی به دنبال اکسیژنرسانی بهتر بافتی، افزایش سرعت متابولیسم و کاهش درد با آزادسازی اندورفینها بودهاند [26]. از آنجایی که اثر این مداخله بر علائم نوروپاتی بیماران دیابتیک بررسی نشده است، لذا هدف از انجام این مطالعه بررسی اثر تکار خازنی بر درد و اختلالات حس لمس کف پای این افراد بود.
روش بررسی
بیماران
پژوهش حاضر یک مطالعه کارآزمایی بالینی یکسوکور (بیماران) با طرح پیشآزمون و پسآزمون با گروه کنترل است که روی بیماران دیابتیک نوع دو مبتلا به نوروپاتی محیطی در سال 1398 انجام شد. نمونهگیری به روش غیرتصادفی ساده بود و شرکتکنندگان از بین مراجعهکنندگان درمانگاه دیابت بیمارستان امامحسین(ع) وابسته به دانشگاه علومپزشکی شهید بهشتی انتخاب شدند. سپس در آزمایشگاه بیومکانیک دانشکده توانبخشی دانشگاه علومپزشکی شهید بهشتی به صورت تصادفی در دو گروه آزمایش و کنترل مورد ارزیابی و درمان قرار گرفتند. با توجه به کمی بودن متغیرهای وابسته تحقیق و وجود دو گروه مستقل و به کمک معادله شماره 1، تعداد نهایی نمونهها با استفاده از مطالعه پایلوت به حجم 5 نفر در هر گروه، با احتمال خطای نوع اول 0/05 و توان آزمون 0/80 و احتمال ریزش، در هریک از گروههای آزمایش و کنترل 12 نفر ( 24 پا) تعیین شد و درمجموع 24 بیمار دیابتیک برای مطالعه انتخاب شدند.
معادله شماره 1
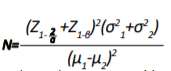
ملاکهای ورود به مطالعه شامل بیماران مرد و زن مبتلا به دیابت نوع دو، علائم نوروپاتی سطح 1 یا 2 در اندام تحتانی، سن بین 18 تا 78 سال، نمره درد 3 یا بیشتر بر اساس مقیاس آنالوگ بصری در ناحیه پاها، سابقه بیشتر از یک سال ابتلا به دیابت و سرعت هدایت عصب حرکتی تیبیال کمتر از 40 متر بر ثانیه و داشتن زندگی مستقل بود. ملاکهای خروج از مطالعه، مشکلات سیستماتیک عروق مرکزی و محیطی، اختلالات کلیوی، بارداری، داشتن اضطراب و استرس و عدم تمایل بیمار به ادامه همکاری در نظر گرفته شد.
ابزار گردآوری دادهها
همه بیماران تحت شیوه یکسان و توسط یک فرد از شروع تا پایان ده جلسه درمان مورد ارزیابی قرار گرفتند. قبل از شروع درمان، اطلاعات جمعیتشناختی بیمار جهت بررسی دقیقتر ثبت شد. برای ارزیابی متغیرهای مورد بحث بیماران از ابزارهایی که در ادامه ذکر شده است، استفاده شد.
مونوفیلامان سیمز وینشتاین 5/07/10 گرمی برای بررسی حس لمس کف پای بیماران دیابتیک استفاده شد (تصویر شماره 1). جهت ارزیابی، بیمارها با چشم بسته به پشت دراز کشیده و فیلامان بر نقاط رو و پشت پای آنها، با فشاری در حد خم شدن سر آن و در مدتی کمتر از یک ثانیه قرار گرفت و افراد تعداد نقاط حسکرده را گزارش کردند. اگر از ده نقطه اعمال مونوفیلامان، فرد قادر به تشخیص هشت نقطه یا بیشتر باشد، حس لمس کف پای وی طبیعی است. در صورتی که فرد یک تا هفت نقطه را تشخیص دهد به معنای کاهش حس لمس و اگر نقطهای را تشخیص ندهد به معنای عدم وجود این حس است [27].
برای اندازهگیری میزان درد پاهای بیمار از مقیاس 10سانتیمتری آنالوگ بینایی استفاده شد. این مقیاس یک روش ذهنی برای ارزیابی ناراحتیهای حسی نظیر درد نوروپاتی دیابتیک پاست که شامل یک خط مستقیم بوده که از صفر تا 10 عددگذاری شده است. یک انتهای آن عدد صفر، به معنای بدون درد و انتهای دیگر، عدد 10، به معنای بیشترین ناراحتی و درد در فرد است. از بیماران خواسته شد دردی را که در پای خود در حالت استراحت احساس میکردند روی نقطهای که به بهترین نحو، شدت درد آنها را نشان میداد، علامتگذاری کنند [28].
روشهای درمان
روند درمان این مطالعه در دو مرحله با اشعه مادون قرمز و تکار خازنی در دو گروه آزمایش و کنترل، طی ده جلسه (سه بار در هفته به مدت چهار هفته)، در آزمایشگاه بیومکانیک دانشکده توانبخشی دانشگاه علومپزشکی شهید بهشتی انجام شد.
1. گروه آزمایش: در این گروه 12 بیمار دیابتیک با 24 پا با علائم نوروپاتی، تحت درمان با اشعه مادون قرمز و تکار واقعی قرار گرفتند.
2. گروه کنترل: در این گروه 12 بیمار دیابتیک با 24 پا با علائم نوروپاتی تحت درمان با اشعه مادون قرمز و تکار شم قرار گرفتند.
در ابتدای روند مداخله، پاهای بیماران تحت درمان با اشعه مادون قرمز قرار گرفتند. آرتور سوسیزلوکی و همکاران اثر کوتاه مدت این مدالیتی را بر بهبود درد و حس لمس کف پای بیماران با نوروپاتی دیابتیک تایید نمودند. این محققان طی مطالعه خود، اشعه مادون قرمز با طول موج 870 نانومتر و دانسیته انرژی 1/8 ژول بر سانتی متر مربع بر دقیقه را به مدت 7 دقیقه بر هر سطح پا اعمال کردند [29].
در پژوهش حاضر، اشعه مادون قرمز با طول موج 890 نانومتر و دانسیته 1/3 ژول بر سانتیمتر مربع بر دقیقه استفاده شد. بیماران یکبار پشت به اشعه و بار دیگر رو به آن به پهلو دراز کشیده و هر سطح دورسال، پلنتار، مدیال و لترال پای آنها با فاصله 80 تا 90 سانتیمتر به مدت 30 دقیقه تحت درمان با این اشعه قرارگرفت (تصویر شماره 2).
در مرحله بعد، درمان به کمک دستگاه تکار از نوع خازنی با مدل TEKRA XCRT, New Ageساخت کشور ایتالیا انجام شد (تصویر شماره 3). این دستگاه بر اساس قوانین فیزیکی دارای دو الکترود فعال و غیرفعال جداگانه متصل به ژنراتور الکتریکی، برای هر دو روش خازنی و مقاومتی است که ولتاژ را بین دو الکترود برقرار مینماید [22]. در پژوهش حاضر به دلیل بررسی آسیب اعصاب کف پای بیماران دیابیتک، از تکار خازنی جهت درمان استفاده شد که این روش باعث افزایش خونرسانی، گرمای موضعی و انبساط عروق بافتی میشود [21].
اصول پایه این پژوهش بر اساس مطالعات گذشته تکارتراپی است [24]، اما به دلیل عدم بررسی اثر آن بر آسیبهای سیستم عصبی، با انجام مطالعه پایلوت روش زیر نتیجهبخش بوده است.
در این روش، بیمار به شکم میخوابید و درمان تکار خازنی در دو طرف مسیر سطحی شدن عصب تیبیال با شدت کمتر از 50 درصد و به صورت پالس (بسته به تحمل بیماران دیابتیک) انجام میشد. به این صورت که ژل دستگاه بر سطح دو الکترود فعال، غیرفعال و پوست بیمار آغشته شده و الکترود غیرفعال آن بر سطح قدامی ساق قرار میگرفت و الکترود فعال آن در مسیر عصب تیبیال هر دو پای بیماران از ناحیه پوپلیته تا قوزک داخلی به طور مداوم به مدت 20 دقیقه حرکت داده میشد (تصویر شماره 4).
روش انجام مداخلات درمانی در گروه کنترل مانند گروه آزمایش بود، با این تفاوت که تکار روشن با شدت صفر در مسیر عصب تیبیال بیماران این گروه اعمال شد. بعد از اتمام ده جلسه درمانی، نمره درد و حس لمس کف پای بیماران دو گروه، بار دیگر مورد ارزیابی قرار گرفت.
در این مطالعه از آزمون کولموگروف اسمیرنف برای بررسی نرمال بودن توزیع دادهها و از میانگین و انحرافمعیار برای توصیف دادهها استفاده شد. همگون بودن دادههای اولیه با استفاده از آزمون تی وابسته، در سطح معنیداری بیشتر از 0/05 بررسی شد. دادههای حاصل از موقعیت پیشآزمون و پسآزمون با استفاده از تحلیل واریانس با اندازهگیری مکرر و به کمک نرمافزار آماری SPSS نسخه 18 تجزیه و تحلیل شدند.
یافتهها
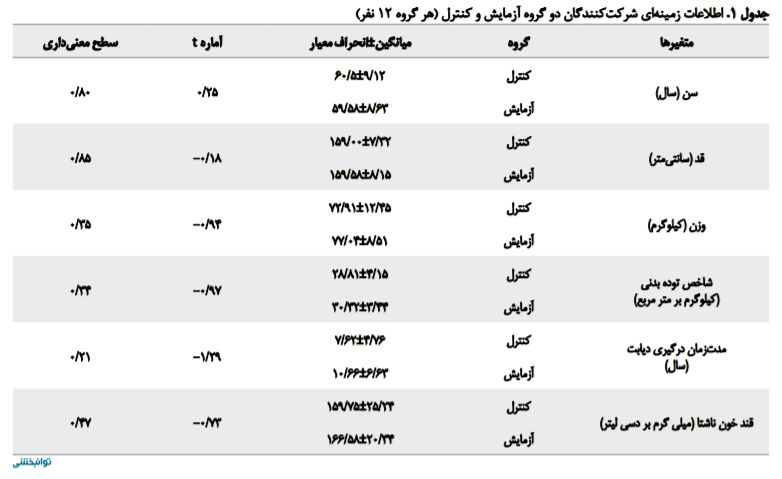
در این مطالعه، 24 بیمار مبتلا به دیابت نوع دو در دو گروه 12نفره آزمایش و کنترل مورد بررسی قرار گرفتند. این افراد همگی دچار نوروپاتی محیطی بوده و پزشک متخصص داخلی، آنها را ارجاع داده بود. هیچکدام از بیماران طی دوره درمان از روند مطالعه خارج نشدند و تمامی افراد شرکتکننده حداقل دو سال به بیماری دیابت مبتلا بودند و از اختلال حسی اندام تحتانی شکایت داشتند (جدول شماره 1).
در این مطالعه از آزمون کولموگروف اسمیرنف برای بررسی نرمال بودن توزیع دادهها و از میانگین و انحرافمعیار برای توصیف دادهها استفاده شد. همگون بودن دادههای اولیه با استفاده از آزمون تی وابسته، در سطح معنیداری بیشتر از 0/05 بررسی شد. دادههای حاصل از موقعیت پیشآزمون و پسآزمون با استفاده از تحلیل واریانس با اندازهگیری مکرر و به کمک نرمافزار آماری SPSS نسخه 18 تجزیه و تحلیل شدند.
یافتهها
در این مطالعه، 24 بیمار مبتلا به دیابت نوع دو در دو گروه 12نفره آزمایش و کنترل مورد بررسی قرار گرفتند. این افراد همگی دچار نوروپاتی محیطی بوده و پزشک متخصص داخلی، آنها را ارجاع داده بود. هیچکدام از بیماران طی دوره درمان از روند مطالعه خارج نشدند و تمامی افراد شرکتکننده حداقل دو سال به بیماری دیابت مبتلا بودند و از اختلال حسی اندام تحتانی شکایت داشتند (جدول شماره 1).
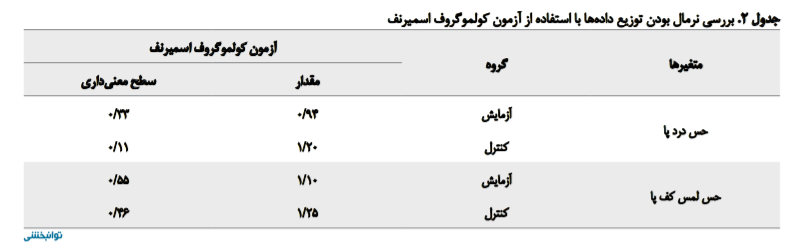
در ابتدای مداخله، تفاوتی از نظر شاخصهای جمعیتشناختی بین بیماران دو گروه وجود نداشت (P>0/05). به منظور بررسی عادی بودن توزیع دادهها از آزمون کولموگروف اسمیرنف استفاده شد. همانطور که در جدول شماره 2 نشان داده شده است، چون مقادیر بهدستآمده برای آزمون کولموگروف اسمیرنف در یک گروه در سطح 0/05 معنیدار نیست، شرط عادی بودن توزیع نمرهها برقرار است.
بنابراین بین گروههای بررسیشده در متغیرهای پژوهش در مرحله پیشآزمون تفاوتی وجود نداشت. به منظور بررسی پیشفرض همگنی واریانسها از آزمون لون استفاده شد (جدول شماره 3). با توجه به اینکه مقدار F معنیدار نیست (p>0/05).
یافتههای مربوط به نمره درد حاصل از مقیاس VAS
ابتدا میزان نمره درد بیماران دو گروه، به کمک آزمون تی مستقل مقایسه شد که با 0/56=P اختلاف در دو گروه آزمایش و کنترل وجود نداشت (جدول شماره 3).

بر اساس جدول شماره 4 مشاهده میشود که میانگین میزان درد، پس از درمان در دو گروه، کاهش معنیدار آماری داشته است (0/001>P).
همچنین تفاوت بین میانگین دادههای دو گروه معنیدار بود؛ یعنی بیماران گروه درمان درمجموع درد کمتری را نسبت به گروه کنترل تجربه کردند (0/002=P). به بیان دیگر، هر دو روش درمانی در کاهش درد بیماران دو گروه آزمایش و کنترل تأثیر داشته است، اما ترکیب اشعه مادون قرمز و تکار خازنی در کاهش درد موفقتر بوده است. به این صورت که میانگین نمره حاصل از مقیاس VAS در دو گروه کنترل و آزمایش به ترتیب، قبل از اعمال مداخله 1/93±5/54 و 1/48±5/25 بوده و پس از اعمال مداخله به 1/60±2/17 و 0/97±0/79 رسیده است.
یافتههای مربوط به نمره حس لمس کف پای حاصل از ابزار مونوفیلامان
بر اساس جدول شماره 3 ابتدا میزان نمره حس لمس کف پای بیماران دو گروه به کمک آزمون تی مستقل مقایسه شد که با 0/482=P در دو گروه آزمایش و کنترل اختلافی وجود نداشت. جدول شماره 4 نشان میدهد که میانگین نمره این حس بعد از ده جلسه درمانی در گروهها افزایش معنیدار آماری داشته است (0/001>P). همچنین وجود تفاوت معنیدار بین دو گروه، بیانگر بهبود بیشتر حس لمس کف پای بیماران گروه آزمایش نسبت به گروه کنترل است (0/001>P). به بیان دیگر، هر دو روش درمانی در بهبود نمره ابزار مونوفیلامان، در دو گروه آزمایش و کنترل تأثیر داشتهاند، اما ترکیب اشعه مادون قرمز و تکار خازنی در بهبود این متغیر موفقتر بودهاست. به این صورت که میانگین نمره حاصل از ابزار مونوفیلامان در دو گروه کنترل و آزمایش به ترتیب، قبل از اعمال مداخله 0/93±5/79 و 1/1±5/58بوده و پس از اعمال مداخله به 1/14±7/79 و 0/64±9/38 رسیده است.
بحث
هدف پژوهش حاضر، بررسی تأثیر تکار خازنی بر علائم ناشی از نوروپاتی محیطی بیماران دیابتیک نوع دو بود. یافتههای پژوهش نشان میدهند ترکیب تکار خازنی و اشعه مادون قرمز بر بهبود علائم نوروپاتی محیطی این بیماران، تأثیر مثبت و معنیداری دارد. با استفاده از این روش جدید، در میانگین متغیر درد و حس لمس کف پا نسبت به تغییرات درمان رایج، بهبودی قابل توجهی حاصل شد. مطالعه منتشرشدهای که تأثیر تکار را بر علائم نوروپاتی محیطی بیماران دیابتیک بررسی نماید، یافت نشد، اما بررسی مطالعات انجامشده در زمینه تأثیر تکارتراپی بر ضایعات عضلانی اسکلتی بیانگر بهبود درد و عملکرد بافتهای آسیبدیده است [30]. این در حالی است که بسیاری از پژوهشهای انجامشده درباره امواج الکترومغناطیسی با فرکانس پایین، تأثیر امواج الکترومغناطیسی را بر متغیرهای مختلف بیماران دیابتیک تأیید کرده و برخی آن را بدون تأثیر درمانی ذکر کردهاند.
یافته پژوهش حاضر نشان داد استفاده از تکار خازنی طی ده جلسه به کاهش درد بیشتر در پای بیماران در گروه آزمایش در مقایسه با گروه کنترل منجر شده است. درد نوروپاتی محیطی از مقاومترین انواع درد نسبت به درمان است [31]. بر اساس مطالعات تقریباً بیش از نیمی از بیماران با علائم نوروپاتی دیابتیک که تحت درمان قرار گرفتند، تسکین درد را تجربه نمیکنند [32].
یافته یکی از پژوهشها نشان داد با استفاده از دستگاه مولد امواج الکترومغناطیسی با فرکانس مدوله یک تا 1000 هرتز طی ده جلسه و تأکید بر افزایش خونرسانی و فاکتور رشد اندوتلیال عروقی بر اعصاب اندام تحتانی بیماران با نوروپاتی دیابیتک، میتوان درد و آستانه حس سرمای آن را بهبود بخشید [14]. همچنین میتوان با استفاده از ترکیب امواج الکترومغناطیسی با فرکانس 50 هرتز و تمریندرمانی و با تحریک بیشتر سیستم عصبی عروقی بافتها، درد پای بیماران را کاهش داد و موجب بهبود سرعت هدایت عصب حسی آنها شد [15]. در حالی که پژوهشی دیگر نشان داده است امواج الکترومغناطیسی پالسدار با فرکانس 50 هرتز و شدت 1800 گاوس در بهبود درد پای بیماران مؤثر نیستند. شدت کم جریان کاربردی، علت عدم تأثیرگذاری این امواج بیان شده است [19].
در تبیین یافتههای این پژوهش میتوان اظهار کرد که ترکیب تکار خازنی در مسیر عصب تیبیال و اشعه مادون قرمز، گیرنده حس درد پای بیماران دیابتیک را تحت تأثیر قرار داده و با آزادسازی اندورفینها و افزایش گرمای بافتی موجب کاهش درد پای آنها شده است.
یافته دیگر این پژوهش، حاکی از بهبود قابل توجه حس لمس کف پای بیماران دیابتیک در گروه آزمایش است. نوروپاتی محیطی به دنبال کاهش حس پاها شیوع زخم پای دیابتیک را افزایش میدهد. از اینرو درمان این اختلال اهمیت فراوانی دارد [6]. یافتهی اخیر با نتایج پژوهش استین و همکاران در سال 2013 مبنی براعمال امواج الکترومغناطیس پالس دار با فرکانس مدوله بر اندام تحتانی بیماران دیابتیک همخوانی دارد. براساس نتایج پژوهش این محققان، امواج الکترومغناطیسی با فعال سازی مستقیم و غیر مستقیم فیبرهای آ دلتا و سی به سمت دیستال آکسون ها، باعث افزایش حس لمس کف پای بیماران می-شود [33]. اما در پژوهش دیگر نشان داده شده است که با وجود استفاده از امواج الکترومغناطیس با فرکانس مدوله 1تا 1000 هرتز بهبودی قابل توجهی در حس لمس کف پا دیده نشد. زیرا تنها بیماران با اختلال خفیف در حس لمس کف پاها، تحت درمان قرار گرفتند [14].
با بررسی یافتههای پژوهش میتوان اظهار کرد که اعمال تکار خازنی در کنار درمان رایج اشعه مادون قرمز با تأکید بر بهبود عملکرد سیستم متابولیسم و عصبی عروقی به افزایش حس لمس در کف پای آنان منجر شده است. به دلیل وجود تناقضات در نتایج مطالعات بررسی میزان تأثیر تکارتراپی (امواج الکترومغناطیسی با فرکانس بالا) مورد بحث قرار گرفته است.
در مطالعه حاضر طی ده جلسه درمانی (چهار هفته) از تکار خازنی مدل TEKRA XCRT, New Age در کنار درمان رایج اشعه مادون قرمز با طول موج 890 نانومتر، به منظور بررسی اثر درمانی آن بر عملکرد اعصاب اندام تحتانی بیماران دیابتیک استفاده شد. بدین منظور در گروه آزمایش، ابتدا سطح پای بیماران به مدت 30 دقیقه و با فاصله 80 تا 90 سانتیمتر، تحت درمان با اشعه مادون قرمز قرار گرفت و سپس الکترود فعال تکار خازنی با شدت کمتر از 50 درصد به مدت 20 دقیقه در مسیر عصب تیبیال از بالا تا پایین حرکت داده شد. اما در گروه کنترل، شدت دستگاه تکار روشن، صفر بود. نتایج مطالعه حاضر بعد از اتمام جلسات درمانی نشان داد تکار خازنی با وجود ایجاد گرمای عمقی و بهبود عملکرد اعصاب بافتهای آسیبدیده، در کنار درمان رایج، باعث بهبود قابل توجه علائم نوروپاتی بیماران دیابتیک نسبت به درمان رایج تنها شده است. به بیان دیگر استفاده از این روش جدید باعث شده است افراد دیابتیک با علائم نوروپاتی محیطی، کاهش درد و بهبود حس لمس کف پای بهتری را تجربه نمایند.
نتیجهگیری
ترکیب بهکاربرده تکار خازنی با داشتن خاصیت گرمایی موضعی و بهبود جریان خون و اشعه مادون قرمز توانسته است به میزان قابل توجهی درد اندام تحتانی را کاهش دهد و حس لمس کف پای بیماران را بهبود بخشد. بر اساس این نتایج میتوان استفاده از این شیوه را به عنوان روش مؤثر در بهبود علائم نوروپاتی محیطی مرتبط با دیابت نوع دو در کنار سایر مدالیتیهای فیزیوتراپی پیشنهاد داد. استفاده از این روش به مدت چهار هفته و طی ده جلسه درمانی یکی از محدودیتهای تحقیق بود که اگر دوره درمان آن افزایش مییافت، نتایج دقیقتری حاصل میشد. از محدودیتهای دیگر آن میتوان به بررسی کوتاهمدت اثر درمان و یکسوکور بودن مطالعه اشاره نمود که این امر میتواند تا حدودی بر نتایج حاصل از آن اثر بگذارد. به علاوه در کشور ما به علت محدودیت پوشش بیمهای جهت تأمین هزینههای مالی این دستگاه، امکان استفاده تمام بیماران دیابتیک از آن فراهم نمیشود. از طرف دیگر مطالعهای در دنیا درباره بررسی اثر تکارتراپی بر علائم نوروپاتی دیابتیک وجود ندارد. درنتیجه امکان ارزیابی و بررسی دقیق درباره نحوه عملکرد این مدالیتی فراهم نیست. محققان این مطالعه انجام مطالعات بیشتری را با پیگیری طولانیمدت در زمینه بررسی تأثیر تکارتراپی بر علائم حسی ناشی از نوروپاتی دیابتیک پیشنهاد میکنند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این طرح در کمیته اخلاق دانشگاه علومپزشکی شهید بهشتی با کد IR.SBMU.RETECH.REC.1397.713 به تصویب رسید همچنین این کارآزمایی در پایگاه ثبت کارآزماییهای بالینی ایران با کد IRCT20190726044337N1 به ثبت رسیده است.
حامی مالی
این مقاله برگرفته از پایاننامه کارشناسی ارشد نویسنده اول خانم مریم نیاءجلیلی،گروه فیزیوتراپی، دانشگاه علومپزشکی شهید بهشتی است.
مشارکت نویسندگان
مفهومسازی: اصغر رضاسلطانی؛ روششناسی: اصغر رضاسلطانی، صدیقه السادات نعیمی، مقداد صداقت، علیرضا اکبرزاده باغبان، مریم نیاءجلیلی؛ تحقیق و بررسی: مریم نیاءجلیلی، اصغر رضاسلطانی، صدیقه السادات نعیمی؛ ویراستاری و نهاییسازی: مریم نیاءجلیلی.
تعارض منافع
بنا بر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
- Guariguata L, Whiting DR, Hambleton I, Beagley J, Linnenkamp U, Shaw JE. Global estimates of diabetes prevalence for 2013 and projections for 2035. Diabetes Research and Clinical Practice. 2014; 103(2):137-49. [DOI:10.1016/j.diabres.2013.11.002] [PMID]
- Basu S, Yudkin JS, Kehlenbrink S, Davies JI, Wild SH, Lipska KJ, et al. Estimation of global insulin use for type 2 diabetes, 2018-30: A microsimulation analysis. The Lancet Diabetes & Endocrinology. 2019; 7(1):25-33. https://www.ncbi.nlm.nih.gov/pubmed/30470520 [DOI:10.1016/S2213-8587(18)30303-6] [PMID]
- American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care. 2014; 37(Suppl 1):S81-90. [DOI:10.2337/dc14-S081] [PMID]
- Forbes JM, Cooper ME. Mechanisms of diabetic complications. Physiological Reviews. 2013; 93(1):137-88. [DOI:10.1152/physrev.00045.2011] [PMID]
- Roque FR, Hernanz R, Salaices M, Briones AM. Exercise training and cardiometabolic diseases: Focus on the vascular system.Current Hyprtension Reports. 2013; 15(3):204-14. [DOI:10.1007/s11906-013-0336-5] [PMID]
- Lee CC, Perkins BA, Kayaniyil S, Harris SB, Retnakaran R, Gerstein HC, et al. Peripheral neuropathy and nerve dysfunction in individuals at high risk for type 2 diabetes: The PROMISE cohort. Diabetes Care. 2015; 38(5):793-800. [DOI:10.2337/dc14-2585] [PMID]
- Venkataraman K, Wee HL, Leow MK, Tai ES, Lee J, Lim SC, et al. Associations between complications and health-related quality of life in individuals with diabetes. Clinical Endocrinology. 2013; 78(6):865-73. [DOI:10.1111/j.1365-2265.2012.04480.x] [PMID]
- Edwards JL, Vincent AM, Cheng HT, Feldman EL. Diabetic neuropathy: Mechanisms to management. Pharmacology & Therapeutics. 2008; 120(1):1-34. [DOI:10.1016/j.pharmthera.2008.05.005] [PMID] [PMCID]
- Dubin AE, Patapoutian A. Nociceptors: The sensors of the pain pathway. The Journal of Clinical Investigation. 2010; 120(11):3760-72. [DOI:10.1172/JCI42843] [PMID] [PMCID]
- Bickel A, Heyer G, Senger C, Maihoefner C, Heuss D, Hilz MJ, et al. C-fiber axon reflex flare size correlates with epidermal nerve fibre density in human skin biopsies. Journal of the Peripheral Nervous System. 2009; 14(4):294-9. [DOI:10.1111/j.1529-8027.2009.00241.x] [PMID]
- Rondón LJ, Privat AM, Daulhac L, Davin N, Mazur A, Fialip J, et al. Magnesium attenuates chronic hypersensitivity and spinal cord NMDA receptor phosphorylation in a rat model of diabetic neuropathic pain. The Journal of Physiology. 2010; 588(21):4205-15. [DOI:10.1113/jphysiol.2010.197004] [PMID] [PMCID]
- Yamany AA, Sayed HM. Effect of low level laser therapy on neurovascular function of diabetic peripheral neuropathy. Journal of Advanced Research. 2012; 3(1):21-8. [DOI:10.1016/j.jare.2011.02.009]
- Conti M, Peretti E, Cazzetta G, Galimberti G, Vermigli C, Pola R, et al. Frequency-modulated electromagnetic neural stimulation enhances cutaneous microvascular flow in patients with diabetic neuropathy. Journal of Diabetes and its Complications. 2009; 23(1):46-8. [DOI:10.1016/j.jdiacomp.2008.02.004] [PMID]
- Bosi E, Bax G, Scionti L, Spallone V, Tesfaye S, Valensi P, et al. Frequency-modulated electromagnetic neural stimulation (FREMS) as a treatment for symptomatic diabetic neuropathy: Results from a double-blind, randomise, multicentre, long-term, placebo-controlled clinical trial. Diabetologia. 2013; 56(3):467-75. [DOI:10.1007/s00125-012-2795-7] [PMID] [PMCID]
- Battecha K. Efficacy of pulsed electromagnetic field on pain and nerve conduction velocity in patients with diabetic neuropathy. Bulletin of Faculty of Physical Therapy. 2017; 22(1):9-14. https://www.bfpt.eg.net/article.asp?issn=1110-6611;year=2017;volume=22;issue=1;spage=9;epage=14;aulast=Battecha
- Sadooghi SD, Zafar Balanezhad S, Nezhad Shahrokh Abadi Kh, Baharara J. [Investigating the effects of low frequency electromagnetic field on MCF-7 cancer cell line (Persian)]. Studies in Medical Sciences. 2014; 25(5):444-52. http://umj.umsu.ac.ir/article-1-2330-en.html
- Sadooghi SD. [Investigating the effects of low frequency electromagnetic field on wound healing in diabetic rats (Persian)]. Journal of Rafsanjan University of Medical Sciences. 2014; 13(3):207-22. http://journal.rums.ac.ir/article-1-1795-en.html
- Bosi E, Conti M, Vermigli C, Cazzetta G, Peretti E, Cordoni MC, et al. Effectiveness of frequency-modulated electromagnetic neural stimulation in the treatment of painful diabetic neuropathy. Diabetologia. 2005; 48(5):817-23. [DOI:10.1007/s00125-005-1734-2] [PMID]
- Weintraub MI, Herrmann DN, Gordon Smith A, Backonja MM, Cole SP. Pulsed electromagnetic fields to reduce diabetic neuropathic pain and stimulate neuronal repair: A randomized controlled trial. Archives of Physical Medicine and Rehabilitation. 2009; 90(7):1102-9. [DOI:10.1016/j.apmr.2009.01.019] [PMID]
- Cameron M. Physical agents in rehabilitation: From research to practice. Philadelphia: Saunders; 2012. https://www.elsevier.com/books/physical-agents-in-rehabilitation/cameron/978-1-4557-4820-4
- Tashiro Y, Hasegawa S, Yokota Y, Nishiguchi Sh, Fukutani N, Shirooka H, et al. Effect of capacitive and resistive electric transfer on haemoglobin saturation and tissue temperature. International Journal of Hyperthermia. 2017; 33(6):696-702. [DOI:10.1080/02656736.2017.1289252] [PMID]
- Kumaran B, Watson T. Thermal build-up, decay and retention responses to local therapeutic application of 448 kHz capacitive resistive monopolar radiofrequency: A prospective randomised crossover study in healthy adults. International Journal of Hyperthermia. 2015; 31(8):883-95. [DOI:10.3109/02656736.2015.1092172] [PMID]
- Wiegerinck JI, Kerkhoffs GM, van Sterkenburg MN, Sierevelt IN, van Dijk CN. Treatment for insertional Achilles tendinopathy: A systematic review. Knee Surgery, Sports Traumatology, Arthroscopy. 2013; 21(6):1345-55. [DOI:10.1007/s00167-012-2219-8] [PMID]
- Notarnicola A, Maccagnano G, Gallone MF, Covelli I, Tafuri S, Moretti B. Short term efficacy of capacitive-resistive diathermy therapy in patients with low back pain: A prospective randomized controlled trial. Journal of Biological Regulators and Homeostatic Agents. 2017; 31(2):509-15. [PMID]
- Costantino C, Vulpiani MC, Romiti D, Vetrano M, Saraceni VM. Cryoultrasound therapy in the treatment of chronic plantar fasciitis with heel spurs. A randomized controlled clinical study. European Journal of Physical and Rehabilitation Medicine. 2014; 50(1):39-47. [PMID]
- Ganzit GP, Stefanini L, Stesina G. Tecar therapy in the treatment of acute and chronic pathologies in sports [Internet]. 2009 [Updated 2009]. Available from: https://www.tr-therapy.com/scientific-support-
- Herman WH, Pop-Busui R, Braffett BH, Martin CL, Cleary PA, Albers JW, et al. Use of the Michigan Neuropathy Screening Instrument as a measure of distal symmetrical peripheral neuropathy in type 1 diabetes: Results from the diabetes control and complications trial/epidemiology of diabetes interventions and complications. Diabetic Medicine. 2012; 29(7):937-44. [DOI:10.1111/j.1464-5491.2012.03644.x] [PMID] [PMCID]
- Eliav E, Gracely RH. Measuring and assessing pain. In: Sharav Y, Benoliel R, editors. Orofacial Pain and Headache. Maryland Heights: Mosby; 2008. [DOI:10.1016/B978-0-7234-3412-2.10003-3]
- Robinson CC, Klahr PDS, Stein C, Falavigna M, Sbruzzi G, Plentz RDM. Effects of monochromatic infrared phototherapy in patients with diabetic peripheral neuropathy: A systematic review and meta-analysis of randomized controlled trials. Brazilian Journal of Physical Therapy. 2017; 21(4):233-43. [DOI:10.1016/j.bjpt.2017.05.008] [PMID] [PMCID]
- Ribeiro S, Henriques B, Cardoso R. The effectiveness of tecar therapy in musculoskeletal disorders. International Journal of Public Health and Health Systems. 2018; 3(5):77-83. http://www.openscienceonline.com/journal/archive2?journalId=755&paperId=4539
- Rutten K, Gould SA, Bryden L, Doods H, Christoph T, Pekcec A. Standard analgesics reverse burrowing deficits in a rat CCI model of neuropathic pain, but not in models of type 1 and type 2 diabetes-induced neuropathic pain. Behavioural Brain Research. 2018; 350:129-38. [DOI:10.1016/j.bbr.2018.04.049] [PMID]
- World Health Organization. Global report on diabetes. Geneva: World Health Organization; 2016. https://books.google.com/books?id=tNsEkAEACAAJ&dq
- Stein C, Eibel B, Sbruzzi G, Lago PD, Plentz RDM. Electrical stimulation and electromagnetic field use in patients with diabetic neuropathy: systematic review and meta-analysis. Brazilian Journal of Physical Therapy. 2013; 17(2):93-104. [DOI:10.1590/S1413-35552012005000083] [PMID]
نوع مطالعه: پژوهشی |
موضوع مقاله:
فیزیوتراپی
دریافت: 1398/8/6 | پذیرش: 1398/12/14 | انتشار: 1399/7/10
دریافت: 1398/8/6 | پذیرش: 1398/12/14 | انتشار: 1399/7/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |