دوره 26، شماره 4 - ( زمستان 1404 )
دوره، شماره، فصل و سال، شماره مسلسل |
برگشت به فهرست نسخه ها
Ethics code: IR.UMA.REC.1404.019
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Piri E, Jafarnezhadgero A, Dehghani M. Effects of Insole Type and Fatigue on the Electrical Activity of Lower Limb Muscles During Running in Men With Foot Pronation and ACL Reconstruction: A Clinical Trial. jrehab 2026; 26 (4) :572-605
URL: http://rehabilitationj.uswr.ac.ir/article-1-3700-fa.html
URL: http://rehabilitationj.uswr.ac.ir/article-1-3700-fa.html
پیری ابراهیم، جعفرنژادگرو امیرعلی، دهقانی ماهرخ. بررسی اثر انواع کفی و خستگی بر طیف فرکانس فعالیت عضلات اندام تحتانی در افراد دارای بازسازی رباط صلیبی قدامی و پای پرونیت طی دویدن: یک کارآزمایی بالینی. مجله توانبخشی. 1404; 26 (4) :572-605
URL: http://rehabilitationj.uswr.ac.ir/article-1-3700-fa.html
1- گروه بیومکانیک ورزشی، دانشکده علوم تربیتی و روانشناسی، دانشگاه محقق اردبیلی، اردبیل، ایران.
2- گروه بیومکانیک ورزشی، دانشکده علوم تربیتی و روانشناسی، دانشگاه محقق اردبیلی، اردبیل، ایران. ،amiralijafarnezhad@gmail.com
2- گروه بیومکانیک ورزشی، دانشکده علوم تربیتی و روانشناسی، دانشگاه محقق اردبیلی، اردبیل، ایران. ،
متن کامل [PDF 6281 kb]
(77 دریافت)
| چکیده (HTML) (1107 مشاهده)
متن کامل: (57 مشاهده)
مقدمه
دویدن، با وجود فواید شناختهشده آن در بهبود آمادگی قلبی-تنفسی و کمک به تعیین تیپ بدنی، با ریسک قابلتوجهی برای اندامهای پایینتنه همراه است، بهطوریکه براساس گزارشها، بین 2 تا 38 مورد آسیب بهازای هر 1000 ساعت دویدن ثبت شده است [1]. آسیبهای جدی مانند پارگی کامل رباط صلیبی قدامی (ACL)، عموماً نیازمند جراحی و به دنبال آن، یک دوره طولانی و برنامهریزیشده توانبخشی برای بازیابی پایداری و عملکرد طبیعی مفصل زانو هستند [2].
حضور همزمان عارضه پرونیشن (چرخش داخلی بیشازحد پا) در کنار پارگی این رباط، چالشهای بالینی قابلتوجهی ایجاد میکند، زیرا رباط ACL نقش محوری در جلوگیری از حرکت استخوان درشتنی نسبت به ران و کنترل چرخش داخلی زانو دارد. عوارض ناشی از توانبخشی ناقص پس از عمل میتواند شامل بیثباتی مفصل، کاهش قدرت عضلانی (بهویژه در عضلات چهارسر ران)، تغییر الگوهای حرکتی و افزایش خطر آسیبهای ثانویه به منیسک و غضروف شود [3، 4]. شیوع پرونیشن پا در جمعیت جوان بین 48 تا 78 درصد و در بزرگسالان بین 20 تا 23 درصد تخمین زده میشود [5، 6]. درمقابل، آمارهای همهگیرشناسی نشان میدهند سالانه 30 تا 70 مورد جدید آسیب ACL بهازای هر 100/000 نفر در جمعیت عمومی رخ میدهد. تنها در ایالات متحده آمریکا، سالانه بیش از 200/000 آسیب جدید گزارش شده است و حدود 100/000 عمل جراحی برای بازسازی این رباط انجام میپذیرد [7].
پرونیشن پا، یک ناهنجاری ساختاری است که با کاهش قوس طولی داخلی پا و تغییر راستای مفصل مچ پا مشخص میگردد [8]. روشهای متعددی برای بازسازی ACL وجود دارد که انتخاب آنها به شدت آسیب و اهداف بیمار بستگی دارد. این روشها شامل استفاده از گرافتهای گرفتهشده از تاندونهای همسترینگ، پاتلا، چهارسر ران یا آشیل است. در انتخاب نوع گرافت، ملاحظاتی مانند سطح فعالیت فرد، سازگاری بیولوژیک بافت پیوندی و استحکام مکانیکی آن در برابر پارگیهای مجدد از اهمیت تعیینکنندهای برخوردارند [9]. براساس پژوهشهای جدید، نرخ شکست جراحیهای بازسازی ACL به دلایلی مانند توانبخشی ناکافی، بازگشت پیشازموعد به ورزش، ضعف عضلانی و تثبیت نشدن کافی گرافت، بین 5 تا 25 درصد است و بیشترین احتمال عود آسیب در 2 سال اول پس از عمل وجود دارد [10، 11].
دراینمیان، پرونیشن پا بهعنوان یک فاکتور خطر مستقل برای پارگی مجدد ACL شناخته میشود. یکی از مکانیسمهای مطرح در این رابطه، القای چرخش داخلی اضافی در ساق پا است که به اعمال استرس غیرطبیعی بر رباط ترمیمشده و افزایش احتمال آسیبهای بعدی منجر میگردد. توزیع نامتعادل فشار روی مفاصل پایینتنه میتواند کارایی عضلات را کاهش دهد و در نهایت موجب بروز اختلالات عملکردی و ناکارآمدی عضلانی شود [12].
مطالعات نشان میدهند در فعالیتهای دینامیک رو به جلو مانند دویدن، عضلات چهارسر ران نقش حیاتی در جلوگیری از حرکات ناخواسته و حفظ تعادل بدن ایفا میکنند [13]. افزایش طیف فرکانسی سیگنالهای الکترومایوگرافی میتواند نشانهای از بهبود هماهنگی عصبی-عضلانی و کارایی عضله باشد. این تغییر احتمالاً ناشی از بهکارگیری تعداد بیشتری از واحدهای حرکتی تندانقباض است که قادر به تولید سیگنالهایی با فرکانس بالاتر بوده و درنتیجه موجب افزایش قدرت و بهبود عملکرد عضلانی حین فعالیتهایی مانند دویدن میشوند [14].
بهطورکلی، افزایش محتوای فرکانسی فعالیت الکتریکی عضلات اغلب نشاندهنده افزایش سطح فعالیت یا شدت انقباض بوده و با فعالسازی فیبرهای عضلانی تندانقباض همراه میباشد [15].خستگی عضلانی، یک پدیده فیزیولوژیک است که بهصورت کاهش قابلیت تولید نیرو توسط عضله تعریف میشود. این حالت به تضعیف قدرت انقباضی، اختلال در هماهنگی بین عضلات و کاهش کلی کارایی سیستم عصبی-عضلانی منجر میگردد [16]. مطابق با پژوهش جعفرنژادگرو و همکاران، خستگی قادر است الگوی فعالیت الکتریکی عضلات را تغییر دهد و این تغییرات میتوانند با افزایش خطر آسیبهای عضلانی همراه باشند [17]. در سطح فیزیولوژیک، خستگی با اختلال در عملکرد پروتئینهای انقباضی (آکتین و میوزین) و کاهش ذخایر انرژی (ATP) مرتبط است که درنهایت به اختلال در عملکرد عضله و افزایش آسیبپذیری آن منجر میشود [18].
یکی از رایجترین مداخلات برای اصلاح الگوهای حرکتی در اندام تحتانی، استفاده از کفیهای کفش است. این وسایل بهطور گستردهای توسط متخصصین حرکات اصلاحی برای اصلاح پرونیشن پا به کار میروند و مطالعات تأثیر معنادار آنها را در کاهش چرخش داخلی ساق پا تأیید کردهاند [19، 20]. از جمله مزایای استفاده از کفیها، کاهش فعالیت الکتریکی عضلاتی است که برای کنترل محوری چرخشها و حفظ راستای اندام تحتانی موردنیاز هستند. بنابراین، جبران پرونیشن پا با کمک کفیهای طبی میتواند اقدامی بسیار مؤثر و کلیدی باشد [21]. تحقیقات نشان دادهاند در افراد دارای پرونیشن، خط اعمال وزن بدن به سمت داخل جابهجا شده و یک گشتاور پروناتوری ایجاد میکند، درحالیکه کفیهای دارای حمایتکننده قوس داخلی، بار خطی را به سمت خارج منتقل کرده و با کاهش نوسانات مرکز فشار، تعادل را در هر دو حالت ایستا و پویا بهبود میبخشند [22].
با وجود مطالعات متعددی که به بررسی اثرات کفیهای مختلف بر الگوی فعالیت عضلانی یا تأثیر خستگی بر عملکرد عضلات پرداختهاند، هیچ مطالعهای بهطور همزمان اثر تعاملی انواع کفی و خستگی را بر طیف فرکانس فعالیت الکتریکی عضلات در بیماران با بازسازی رباط صلیبی قدامی و پای پرونیت در بازههای زمانی مختلف پس از جراحی مورد بررسی قرار نداده است. این در حالی است که این بیماران در طول فعالیتهای روزمره و ورزشی اغلب با هر دو عامل خستگی و استفاده از کفی مواجه هستند. بنابراین، عدم وجود چنین مطالعهای به معنای یک شکاف واضح در ادبیات علمی است. شناخت این اثرات تعاملی میتواند به طراحی پروتکلهای توانبخشی دقیقتر، تجویز بهینهتر وسایل کمکی مانند کفی و درنهایت پیشگیری از آسیبهای مجدد در این بیماران منجر شود. ازاینرو، انجام پژوهش حاضر با در نظر گرفتن همزمان متغیرهای کلیدی مذکور، اجتنابناپذیر و ضروری به نظر میرسد.
روش بررسی
پژوهش حاضر از نوع نیمهآزمایشی و کارآزمایی بالینی بود که بهصورت قبل و بعد از خستگی (اثر آنی استفاده انواع کفی)، در آزمایشگاه بیومکانیک ورزشی در مرکز سلامت و تندرستی دانشگاه محقق اردبیلی انجام شد. برای تعیین حداقل حجم نمونه از نرمافزار جیپاور نسخه 3، 1 استفاده شد که این نرمافزار نشان داد در سطح معنیداری 0/05، اندازه اثر 0/8 و توان آماری 0/8، حداقل تعداد کل نمونه برابر با 16 نفر میباشد [23].
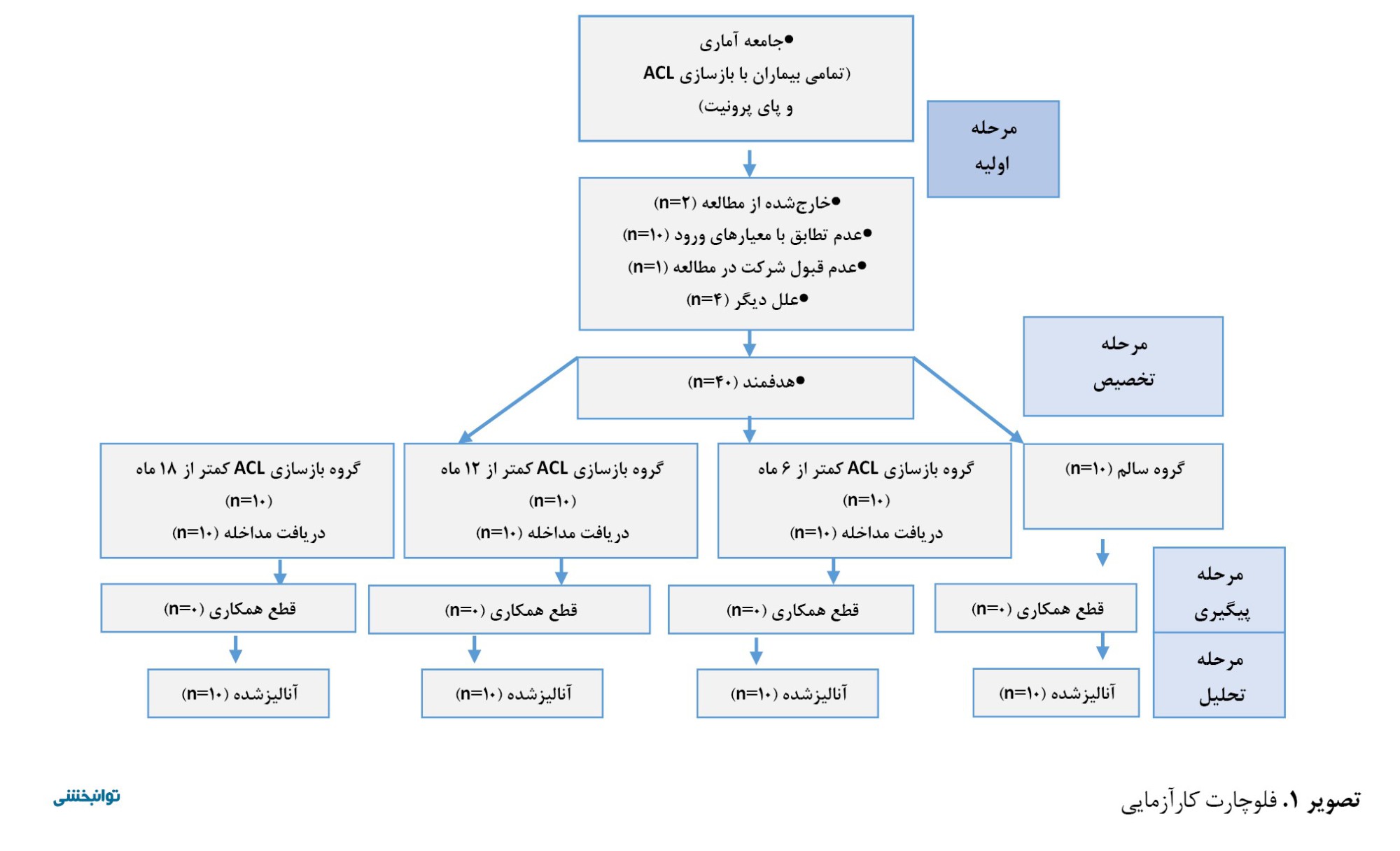
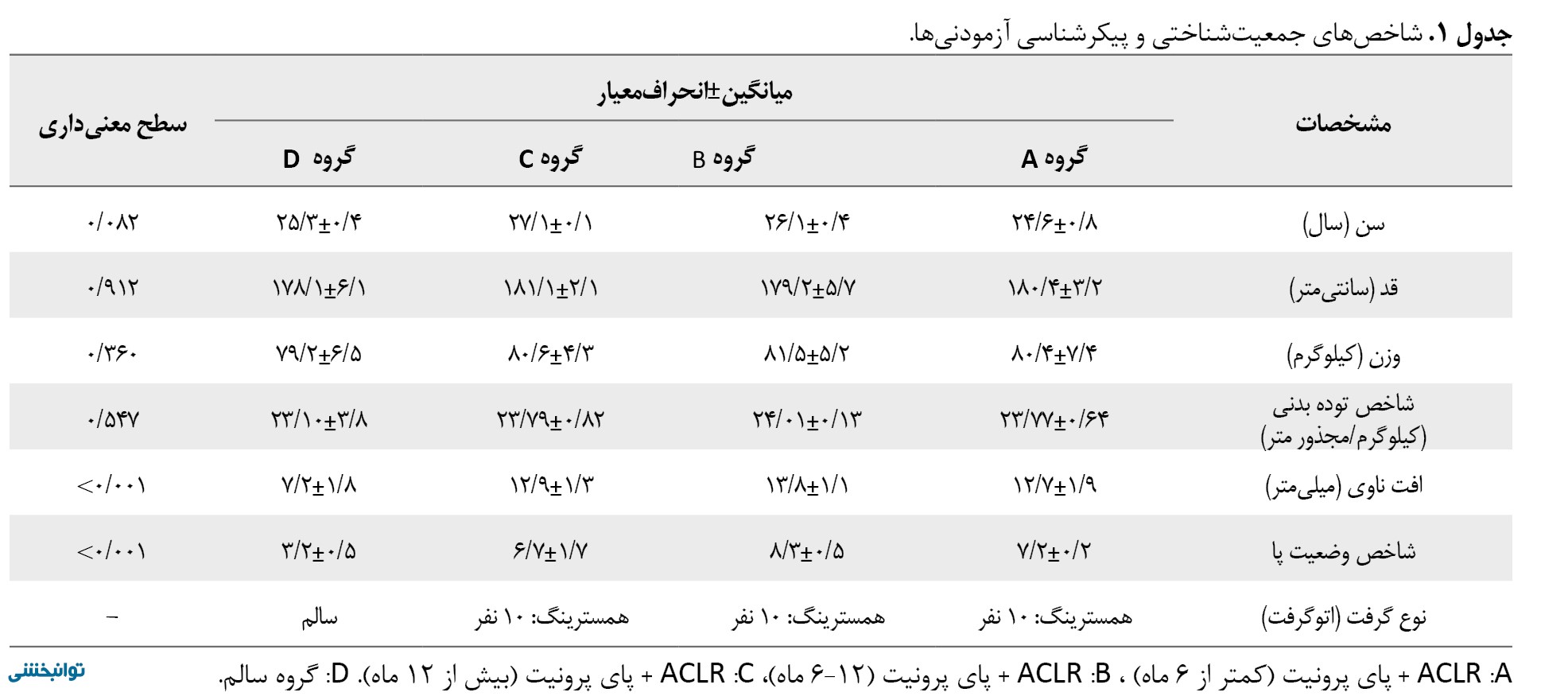
جامعه آماری پژوهش حاضر شامل تمامی بیماران با بازسازی رباط ACL همراه با پای پرونیت و افراد سالم بود. نمونه آماری شامل 30 مرد (با بازسازی رباط ACL و پای پرونیت) و 10 مرد سالم، استان اردبیل با دامنه سنی 18-45 سال بودند که بهطور دسترس در این پژوهش شرکت کردند. آزمودنیها در چهار گروه جای گرفتند که بدین قرار است:
1. افراد دارای بازسازی ACL و پای پرونیت که کمتر از 6 ماه از بازسازی رباط آنها گذشته است.
2. افراد دارای بازسازی ACL و پای پرونیت که در بازه زمانی 6-12 ماه پس از بازسازی قرار دارند.
3. افراد دارای بازسازی ACL و پای پرونیت که در بازه زمانی بیش از 12 ماه پس از بازسازی قرار دارند.
4. گروه سالم (تصویر شماره 1).
دویدن، با وجود فواید شناختهشده آن در بهبود آمادگی قلبی-تنفسی و کمک به تعیین تیپ بدنی، با ریسک قابلتوجهی برای اندامهای پایینتنه همراه است، بهطوریکه براساس گزارشها، بین 2 تا 38 مورد آسیب بهازای هر 1000 ساعت دویدن ثبت شده است [1]. آسیبهای جدی مانند پارگی کامل رباط صلیبی قدامی (ACL)، عموماً نیازمند جراحی و به دنبال آن، یک دوره طولانی و برنامهریزیشده توانبخشی برای بازیابی پایداری و عملکرد طبیعی مفصل زانو هستند [2].
حضور همزمان عارضه پرونیشن (چرخش داخلی بیشازحد پا) در کنار پارگی این رباط، چالشهای بالینی قابلتوجهی ایجاد میکند، زیرا رباط ACL نقش محوری در جلوگیری از حرکت استخوان درشتنی نسبت به ران و کنترل چرخش داخلی زانو دارد. عوارض ناشی از توانبخشی ناقص پس از عمل میتواند شامل بیثباتی مفصل، کاهش قدرت عضلانی (بهویژه در عضلات چهارسر ران)، تغییر الگوهای حرکتی و افزایش خطر آسیبهای ثانویه به منیسک و غضروف شود [3، 4]. شیوع پرونیشن پا در جمعیت جوان بین 48 تا 78 درصد و در بزرگسالان بین 20 تا 23 درصد تخمین زده میشود [5، 6]. درمقابل، آمارهای همهگیرشناسی نشان میدهند سالانه 30 تا 70 مورد جدید آسیب ACL بهازای هر 100/000 نفر در جمعیت عمومی رخ میدهد. تنها در ایالات متحده آمریکا، سالانه بیش از 200/000 آسیب جدید گزارش شده است و حدود 100/000 عمل جراحی برای بازسازی این رباط انجام میپذیرد [7].
پرونیشن پا، یک ناهنجاری ساختاری است که با کاهش قوس طولی داخلی پا و تغییر راستای مفصل مچ پا مشخص میگردد [8]. روشهای متعددی برای بازسازی ACL وجود دارد که انتخاب آنها به شدت آسیب و اهداف بیمار بستگی دارد. این روشها شامل استفاده از گرافتهای گرفتهشده از تاندونهای همسترینگ، پاتلا، چهارسر ران یا آشیل است. در انتخاب نوع گرافت، ملاحظاتی مانند سطح فعالیت فرد، سازگاری بیولوژیک بافت پیوندی و استحکام مکانیکی آن در برابر پارگیهای مجدد از اهمیت تعیینکنندهای برخوردارند [9]. براساس پژوهشهای جدید، نرخ شکست جراحیهای بازسازی ACL به دلایلی مانند توانبخشی ناکافی، بازگشت پیشازموعد به ورزش، ضعف عضلانی و تثبیت نشدن کافی گرافت، بین 5 تا 25 درصد است و بیشترین احتمال عود آسیب در 2 سال اول پس از عمل وجود دارد [10، 11].
دراینمیان، پرونیشن پا بهعنوان یک فاکتور خطر مستقل برای پارگی مجدد ACL شناخته میشود. یکی از مکانیسمهای مطرح در این رابطه، القای چرخش داخلی اضافی در ساق پا است که به اعمال استرس غیرطبیعی بر رباط ترمیمشده و افزایش احتمال آسیبهای بعدی منجر میگردد. توزیع نامتعادل فشار روی مفاصل پایینتنه میتواند کارایی عضلات را کاهش دهد و در نهایت موجب بروز اختلالات عملکردی و ناکارآمدی عضلانی شود [12].
مطالعات نشان میدهند در فعالیتهای دینامیک رو به جلو مانند دویدن، عضلات چهارسر ران نقش حیاتی در جلوگیری از حرکات ناخواسته و حفظ تعادل بدن ایفا میکنند [13]. افزایش طیف فرکانسی سیگنالهای الکترومایوگرافی میتواند نشانهای از بهبود هماهنگی عصبی-عضلانی و کارایی عضله باشد. این تغییر احتمالاً ناشی از بهکارگیری تعداد بیشتری از واحدهای حرکتی تندانقباض است که قادر به تولید سیگنالهایی با فرکانس بالاتر بوده و درنتیجه موجب افزایش قدرت و بهبود عملکرد عضلانی حین فعالیتهایی مانند دویدن میشوند [14].
بهطورکلی، افزایش محتوای فرکانسی فعالیت الکتریکی عضلات اغلب نشاندهنده افزایش سطح فعالیت یا شدت انقباض بوده و با فعالسازی فیبرهای عضلانی تندانقباض همراه میباشد [15].خستگی عضلانی، یک پدیده فیزیولوژیک است که بهصورت کاهش قابلیت تولید نیرو توسط عضله تعریف میشود. این حالت به تضعیف قدرت انقباضی، اختلال در هماهنگی بین عضلات و کاهش کلی کارایی سیستم عصبی-عضلانی منجر میگردد [16]. مطابق با پژوهش جعفرنژادگرو و همکاران، خستگی قادر است الگوی فعالیت الکتریکی عضلات را تغییر دهد و این تغییرات میتوانند با افزایش خطر آسیبهای عضلانی همراه باشند [17]. در سطح فیزیولوژیک، خستگی با اختلال در عملکرد پروتئینهای انقباضی (آکتین و میوزین) و کاهش ذخایر انرژی (ATP) مرتبط است که درنهایت به اختلال در عملکرد عضله و افزایش آسیبپذیری آن منجر میشود [18].
یکی از رایجترین مداخلات برای اصلاح الگوهای حرکتی در اندام تحتانی، استفاده از کفیهای کفش است. این وسایل بهطور گستردهای توسط متخصصین حرکات اصلاحی برای اصلاح پرونیشن پا به کار میروند و مطالعات تأثیر معنادار آنها را در کاهش چرخش داخلی ساق پا تأیید کردهاند [19، 20]. از جمله مزایای استفاده از کفیها، کاهش فعالیت الکتریکی عضلاتی است که برای کنترل محوری چرخشها و حفظ راستای اندام تحتانی موردنیاز هستند. بنابراین، جبران پرونیشن پا با کمک کفیهای طبی میتواند اقدامی بسیار مؤثر و کلیدی باشد [21]. تحقیقات نشان دادهاند در افراد دارای پرونیشن، خط اعمال وزن بدن به سمت داخل جابهجا شده و یک گشتاور پروناتوری ایجاد میکند، درحالیکه کفیهای دارای حمایتکننده قوس داخلی، بار خطی را به سمت خارج منتقل کرده و با کاهش نوسانات مرکز فشار، تعادل را در هر دو حالت ایستا و پویا بهبود میبخشند [22].
با وجود مطالعات متعددی که به بررسی اثرات کفیهای مختلف بر الگوی فعالیت عضلانی یا تأثیر خستگی بر عملکرد عضلات پرداختهاند، هیچ مطالعهای بهطور همزمان اثر تعاملی انواع کفی و خستگی را بر طیف فرکانس فعالیت الکتریکی عضلات در بیماران با بازسازی رباط صلیبی قدامی و پای پرونیت در بازههای زمانی مختلف پس از جراحی مورد بررسی قرار نداده است. این در حالی است که این بیماران در طول فعالیتهای روزمره و ورزشی اغلب با هر دو عامل خستگی و استفاده از کفی مواجه هستند. بنابراین، عدم وجود چنین مطالعهای به معنای یک شکاف واضح در ادبیات علمی است. شناخت این اثرات تعاملی میتواند به طراحی پروتکلهای توانبخشی دقیقتر، تجویز بهینهتر وسایل کمکی مانند کفی و درنهایت پیشگیری از آسیبهای مجدد در این بیماران منجر شود. ازاینرو، انجام پژوهش حاضر با در نظر گرفتن همزمان متغیرهای کلیدی مذکور، اجتنابناپذیر و ضروری به نظر میرسد.
روش بررسی
پژوهش حاضر از نوع نیمهآزمایشی و کارآزمایی بالینی بود که بهصورت قبل و بعد از خستگی (اثر آنی استفاده انواع کفی)، در آزمایشگاه بیومکانیک ورزشی در مرکز سلامت و تندرستی دانشگاه محقق اردبیلی انجام شد. برای تعیین حداقل حجم نمونه از نرمافزار جیپاور نسخه 3، 1 استفاده شد که این نرمافزار نشان داد در سطح معنیداری 0/05، اندازه اثر 0/8 و توان آماری 0/8، حداقل تعداد کل نمونه برابر با 16 نفر میباشد [23].
جامعه آماری پژوهش حاضر شامل تمامی بیماران با بازسازی رباط ACL همراه با پای پرونیت و افراد سالم بود. نمونه آماری شامل 30 مرد (با بازسازی رباط ACL و پای پرونیت) و 10 مرد سالم، استان اردبیل با دامنه سنی 18-45 سال بودند که بهطور دسترس در این پژوهش شرکت کردند. آزمودنیها در چهار گروه جای گرفتند که بدین قرار است:
1. افراد دارای بازسازی ACL و پای پرونیت که کمتر از 6 ماه از بازسازی رباط آنها گذشته است.
2. افراد دارای بازسازی ACL و پای پرونیت که در بازه زمانی 6-12 ماه پس از بازسازی قرار دارند.
3. افراد دارای بازسازی ACL و پای پرونیت که در بازه زمانی بیش از 12 ماه پس از بازسازی قرار دارند.
4. گروه سالم (تصویر شماره 1).
شاخصهای جمعیتشناختی آزمودنیها در جدول شماره 1، ارائه شده است.
همچنین پای راست طی آزمون شوت فوتبال بهعنوان پای برتر تمامی آزمودنیها مشخص گردید [24].
شرایط ورود به پژوهش شامل افراد دارای بازسازی ACL و پای پرونیت ﮐﻪ در بازه زمانی 6، 12 و 18 ماه پس از بازسازی قرار دارند. عدم احساس درد در دامنههای حرکتی، توانایی دویدن بدون احساس هیچگونه محدودیت، علاقمند بودن برای شرکت در پژوهش، دامنه سن بین 18-45 سال و عدم ابتلا به سایر ناهنجاریهای اندام تحتانی همچون پای پرانتزی، عدم سابقه طولانیمدت مصرف داروهای مؤثر بر سیستم عضلانی-اسکلتی، داشتن شاخص توده بدنی 25 تا 18/5 (کیلوگرم بر مجذور متر)، داشتن پیوند همسترینگ، زاویه انحراف قسمت عقبی پا بیش از 4 درجه، شاخص پاسچر پا 10میلیمتر بیشتر باشد و افتادگی ناوی بیش از 1 سانتیمتر.
شرایط خروج آزمودنیها از پژوهش شامل عدم تقارن طول اندام تحتانی بالای 5 میلیمتر و عدم تمایل به همکاری بود. همچنین در کلیه مراحل پژوهش، اخلاق پژوهشی رعایت شد و از آزمودنیها رضایتنامه حضور در پژوهش اخذ شد [25]. تمام بخشهای اجرایی پژوهش حاضر بر طبق بیانیه هلسینکی انجام شد [26].
در طول جمعآوری دادهها از همه آزمودنیها خواسته شد قبل از شرکت در آزمون فرم رضایتنامه حضور در آزمون را پر کنند و 48 ساعت قبل از حضور در آزمون فعالیت شدید ورزشی نداشته باشند تا صرفاً تنها اثر خستگی آنی ایجادشده در آزمایشگاه (شرایط یکسان) مورد بررسی قرار گیرد [27، 28].
روش جمعآوری
آزمودنیها کوشش دویدن را در مسیر 18 متری آزمایشگاه پس از قرارگیری الکترودها روی عضلات انجام دادند. هر مرحله با سه کوشش صحیح ثبت شد. برای کنترل و نظارت سرعت دویدن (3/2 متر بر ثانیه) دو مجموعه از فتوسل مادون قرمز (ولز جنوبی، استرالیا) استفاده شد [3]. برای آشنایی آزمودنیها با مسیر دویدن 3 مرتبه مسیر موردنظر توسط آزمودنیها طی شد. برای مقایسه اثر احتمالی سرعت دویدن و کنترل آن در تجزیهوتحلیل اطلاعات در طول مسیر، سرعت دویدن فرد با سرعتسنج کنترل گردید تا اختلافی در سرعت دویدن نداشته باشند. سه آزمایش در هر شرایط انجام شد.
معیارهای عینی برای کنار گذاشتن یک کارآزمایی عبارت بودند از:
1. اگر دادهها ناقص بود یا نویز داشت.
2. آزمودنی تعادل خود را در طول آزمایش از دست میداد.
3. با الگوی نامتعارفی میدویدند.
لازم به ذکر است که کوششی صحیح در نظر گرفته میشد که سیگنال الکترومایوگرافی تمامی عضلات بهصورت صحیح ثبت شده باشد [29].
میزان فعالیت عضله ساقی-قدامی، دوقلوی داخلی، پهن داخلی، پهن خارجی، راست رانی، دوسررانی، نیمهوتری و عضله سرینی میانی پای سمت راست آزمودنیها طی دویدن ثبت شد. برای ثبت فعالیت الکتریکی عضلات از دستگاه الکترومایوگرافی بایومتریک (biometrics ltd, UK) 8 کاناله بیسیم و الکتروهای سطحی (EMG)، مدل دو قطبی (ساخت کشور انگلستان) جفت الکترودهای سطحی نقره/کلرید نقره دوقطبی (شکل دایرهای با قطر 11 میلیمتر؛ فاصله 25 میلیمتر از مرکز تا مرکز؛ امپدانس ورودی 100 مگااهم ؛ نسبت رد شایع حالت >110 دسیبل در 50 تا 60 هرتز) استفاده شد (Biometrics ltd, UK). فیلترهای پایینگذر 500 هرتز و بالاگذر 10 هرتز و همچنین ناچ فیلتر (برای حذف نویز برق شهری) 60 هرتز جهت فیلترینگ دادههای خام الکترومایوگرافی انتخاب شد [30]. همچنین نرخ نمونهبرداری در فعالیت الکتریکی عضلات برابر با 1000 هرتز قرار گرفت. محل عضلات منتخب و اعمالی مانند تراشیدن محل الکترودگذاری و تمیز کردن با الکل (70 درصد اتانول-C2H5OH) طبق توصیهنامه (SurfaceElectromyography for the Non Invasive Assessment of Muscles; SENIAM) انجام شد [31، 32].
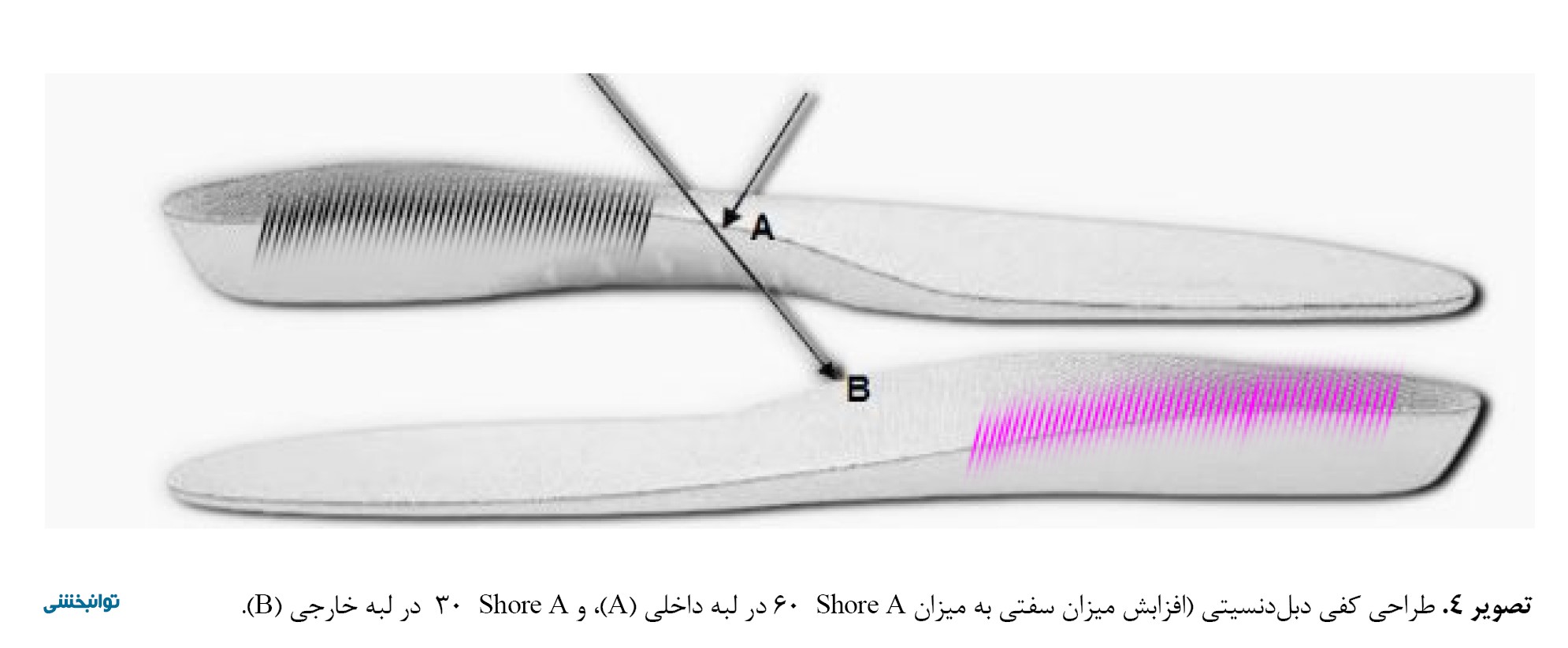
در این مطالعه آزمودنیهای هر چهار گروه (A,B,C,D)، در مرحله قبل و بعد از خستگی در چهار شرایط مختلف (کفش کنترل، کفی پلاسبو، کفی حمایتکننده قوس، و کفی دبل دنسیتی) مسیر مربوط را دویدند. سایزهای مختلفی از انواع کفیها فراهم بود. کفی حمایتکننده قوس مورداستفاده در این پژوهش دارای برجستگی در قسمت لبه داخلی پا بود. ارتفاع قله قوس طولی-داخلی در این کفی برابر با 25 میلیمتر و میزان posting (بیشترین اختلاف ارتفاع لبه داخلی از لبه خارجی) آن 15 میلیمتر بود. طول این کفی به اندازهای بود که بخش عقب و میانی پا را پوشش میداد و در بخش جلویی پا قرار نداشت. جنس این کفی از نوع سخت پلییورتان بود و بهطور کامل قوس پا را پوشش میداد. برای هر آزمودنی متناسب با اندازه پای فرد کفی مناسب مورد استفاده قرار گرفت (تصویر شماره 2).

همچنین پای راست طی آزمون شوت فوتبال بهعنوان پای برتر تمامی آزمودنیها مشخص گردید [24].
شرایط ورود به پژوهش شامل افراد دارای بازسازی ACL و پای پرونیت ﮐﻪ در بازه زمانی 6، 12 و 18 ماه پس از بازسازی قرار دارند. عدم احساس درد در دامنههای حرکتی، توانایی دویدن بدون احساس هیچگونه محدودیت، علاقمند بودن برای شرکت در پژوهش، دامنه سن بین 18-45 سال و عدم ابتلا به سایر ناهنجاریهای اندام تحتانی همچون پای پرانتزی، عدم سابقه طولانیمدت مصرف داروهای مؤثر بر سیستم عضلانی-اسکلتی، داشتن شاخص توده بدنی 25 تا 18/5 (کیلوگرم بر مجذور متر)، داشتن پیوند همسترینگ، زاویه انحراف قسمت عقبی پا بیش از 4 درجه، شاخص پاسچر پا 10میلیمتر بیشتر باشد و افتادگی ناوی بیش از 1 سانتیمتر.
شرایط خروج آزمودنیها از پژوهش شامل عدم تقارن طول اندام تحتانی بالای 5 میلیمتر و عدم تمایل به همکاری بود. همچنین در کلیه مراحل پژوهش، اخلاق پژوهشی رعایت شد و از آزمودنیها رضایتنامه حضور در پژوهش اخذ شد [25]. تمام بخشهای اجرایی پژوهش حاضر بر طبق بیانیه هلسینکی انجام شد [26].
در طول جمعآوری دادهها از همه آزمودنیها خواسته شد قبل از شرکت در آزمون فرم رضایتنامه حضور در آزمون را پر کنند و 48 ساعت قبل از حضور در آزمون فعالیت شدید ورزشی نداشته باشند تا صرفاً تنها اثر خستگی آنی ایجادشده در آزمایشگاه (شرایط یکسان) مورد بررسی قرار گیرد [27، 28].
روش جمعآوری
آزمودنیها کوشش دویدن را در مسیر 18 متری آزمایشگاه پس از قرارگیری الکترودها روی عضلات انجام دادند. هر مرحله با سه کوشش صحیح ثبت شد. برای کنترل و نظارت سرعت دویدن (3/2 متر بر ثانیه) دو مجموعه از فتوسل مادون قرمز (ولز جنوبی، استرالیا) استفاده شد [3]. برای آشنایی آزمودنیها با مسیر دویدن 3 مرتبه مسیر موردنظر توسط آزمودنیها طی شد. برای مقایسه اثر احتمالی سرعت دویدن و کنترل آن در تجزیهوتحلیل اطلاعات در طول مسیر، سرعت دویدن فرد با سرعتسنج کنترل گردید تا اختلافی در سرعت دویدن نداشته باشند. سه آزمایش در هر شرایط انجام شد.
معیارهای عینی برای کنار گذاشتن یک کارآزمایی عبارت بودند از:
1. اگر دادهها ناقص بود یا نویز داشت.
2. آزمودنی تعادل خود را در طول آزمایش از دست میداد.
3. با الگوی نامتعارفی میدویدند.
لازم به ذکر است که کوششی صحیح در نظر گرفته میشد که سیگنال الکترومایوگرافی تمامی عضلات بهصورت صحیح ثبت شده باشد [29].
میزان فعالیت عضله ساقی-قدامی، دوقلوی داخلی، پهن داخلی، پهن خارجی، راست رانی، دوسررانی، نیمهوتری و عضله سرینی میانی پای سمت راست آزمودنیها طی دویدن ثبت شد. برای ثبت فعالیت الکتریکی عضلات از دستگاه الکترومایوگرافی بایومتریک (biometrics ltd, UK) 8 کاناله بیسیم و الکتروهای سطحی (EMG)، مدل دو قطبی (ساخت کشور انگلستان) جفت الکترودهای سطحی نقره/کلرید نقره دوقطبی (شکل دایرهای با قطر 11 میلیمتر؛ فاصله 25 میلیمتر از مرکز تا مرکز؛ امپدانس ورودی 100 مگااهم ؛ نسبت رد شایع حالت >110 دسیبل در 50 تا 60 هرتز) استفاده شد (Biometrics ltd, UK). فیلترهای پایینگذر 500 هرتز و بالاگذر 10 هرتز و همچنین ناچ فیلتر (برای حذف نویز برق شهری) 60 هرتز جهت فیلترینگ دادههای خام الکترومایوگرافی انتخاب شد [30]. همچنین نرخ نمونهبرداری در فعالیت الکتریکی عضلات برابر با 1000 هرتز قرار گرفت. محل عضلات منتخب و اعمالی مانند تراشیدن محل الکترودگذاری و تمیز کردن با الکل (70 درصد اتانول-C2H5OH) طبق توصیهنامه (SurfaceElectromyography for the Non Invasive Assessment of Muscles; SENIAM) انجام شد [31، 32].
در این مطالعه آزمودنیهای هر چهار گروه (A,B,C,D)، در مرحله قبل و بعد از خستگی در چهار شرایط مختلف (کفش کنترل، کفی پلاسبو، کفی حمایتکننده قوس، و کفی دبل دنسیتی) مسیر مربوط را دویدند. سایزهای مختلفی از انواع کفیها فراهم بود. کفی حمایتکننده قوس مورداستفاده در این پژوهش دارای برجستگی در قسمت لبه داخلی پا بود. ارتفاع قله قوس طولی-داخلی در این کفی برابر با 25 میلیمتر و میزان posting (بیشترین اختلاف ارتفاع لبه داخلی از لبه خارجی) آن 15 میلیمتر بود. طول این کفی به اندازهای بود که بخش عقب و میانی پا را پوشش میداد و در بخش جلویی پا قرار نداشت. جنس این کفی از نوع سخت پلییورتان بود و بهطور کامل قوس پا را پوشش میداد. برای هر آزمودنی متناسب با اندازه پای فرد کفی مناسب مورد استفاده قرار گرفت (تصویر شماره 2).
کفی پلاسبو همان کفیهای عادی است که در بازار به فروش میرسد؛ بهمنظور یکسانسازی شرایط جمعآوری دادهها از کفش کنترل در سایزهای متفاوت برای تمامی گروهها استفاده گردید (تصویر شماره 3)،
درحالیکه کفی دبلدنسیتی ساخته شده از اتیلن-وینیل استات بود که سفتی قسمت داخلی Shore A 60 و سفتی قسمت خارجی Shore A 30 با حفظ اختلاف ارتفاع تکیهگاه قوس طولی-داخلی میباشد (تصویر شماره 4).
کفی دبلدنسیتی دارای سفتی مختلفی در ناحیه بالشتک پاشنه میباشد که با شیب 8 درجه داخل نسبت به خارج ساخته شده است. باتوجهبه سفتی متفاوت طراحیشده در این کفی ممکن است اثرات متفاوتی را در کاهش و رهاسازی نیروهای وارده از زمین در مکانیک دویدن داشته باشد. وجه تمایز این نوع کفی رفع مشکل اختلاف ارتفاع در قسمت داخلی و خارجی آن میباشد، زیرا براساس مطالعههای گذشته که این مورد را نادیده گرفته بودند ازلحاظ بیومکانیکی میتوانست حتی بهصورت جزئی باعث تغییر الگوی حرکتی گردد [33].
پروتکل خستگی برای آزمودنیها با استفاده از تردمیل پیشرفته مدل (Horizon Fitness, Omega GT, USA) بدون شیب انجام شد. در هنگام شروع آزمودنیها درحالیکه با سرعت 6 کیلومتر در ساعت راه میرفتند، پروتکل را شروع کردند و سرعت تردمیل هر 2 دقیقه 1 کیلومتر در ساعت افزایش یافت. از مقیاسی ادراکی بورگ (6-20) جهت تعیین لحظه نهایی خستگی شرکتکنندگان استفاده شد [34]. به محض اینکه شرکتکنندگان ادراک 13 یا بالاتر را در مقیاس بورگ گزارش کردند، سرعت تردمیل ثابت شد تا اجازه دویدن در حالت ثابت را بدهد. در طول مرحله دویدن در حالت پایدار، امتیاز تلاش درکشده هر 30 ثانیه ارزیابی میشد و پروتکل خستگی پس از 2 دقیقه دویدن در حالت پایدار بیش از 17 در مقیاس 6 تا 20 بورگ یا 80 درصد حداکثر ضربان قلب یه پایان میرسید [35].
تجزیه و تحلیل آماری
نرمال بودن دادهها با استفاده از آزمون شاپیرو-ویلک تأیید شد. از آزمون آنالیز واریانس دوسویه با اندازهگیریهای تکراری استفاده شد. تمام تحلیلها در سطح معنیداری 05/P<0 و با استفاده از نرمافزار SPSS نسخه 23 انجام پذیرفت. برای بررسی همگنی از آزمون لون در سطح معنیداری برابر با 0/05≥P استفاده شد. تمام تجزیهوتحلیل آماری با استفاده از نرمافزار اکسل و نرمافزار SPSS نسخه 23 انجام شد [32].
یافتهها
طیف فرکانس فعالیت الکتریکی عضلات اندام تحتانی طی فازهای مختلف دویدن بین پیشآزمون گروههای موردمطالعه هیچ تفاوت معنیداری نداشت (05/P>0). براساس جدول شماره 2، اثر عامل خستگی ازلحاظ آماری برای عضله درشتنی قدامی طی فاز بارگذاری (0/215=d؛ 0/024=P)، و هل دادن معنادار بود (0/200=d؛ 0/003=P).
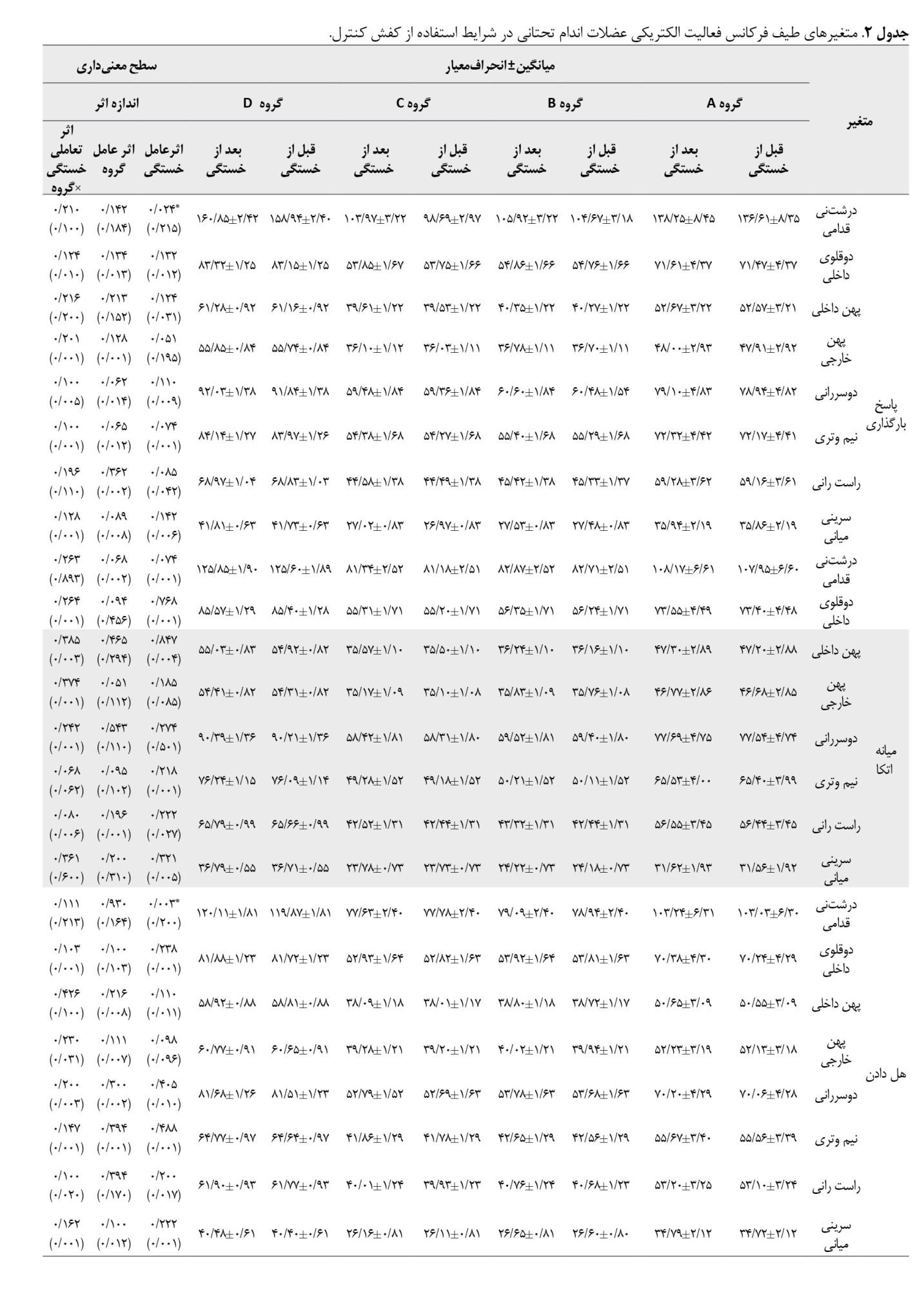
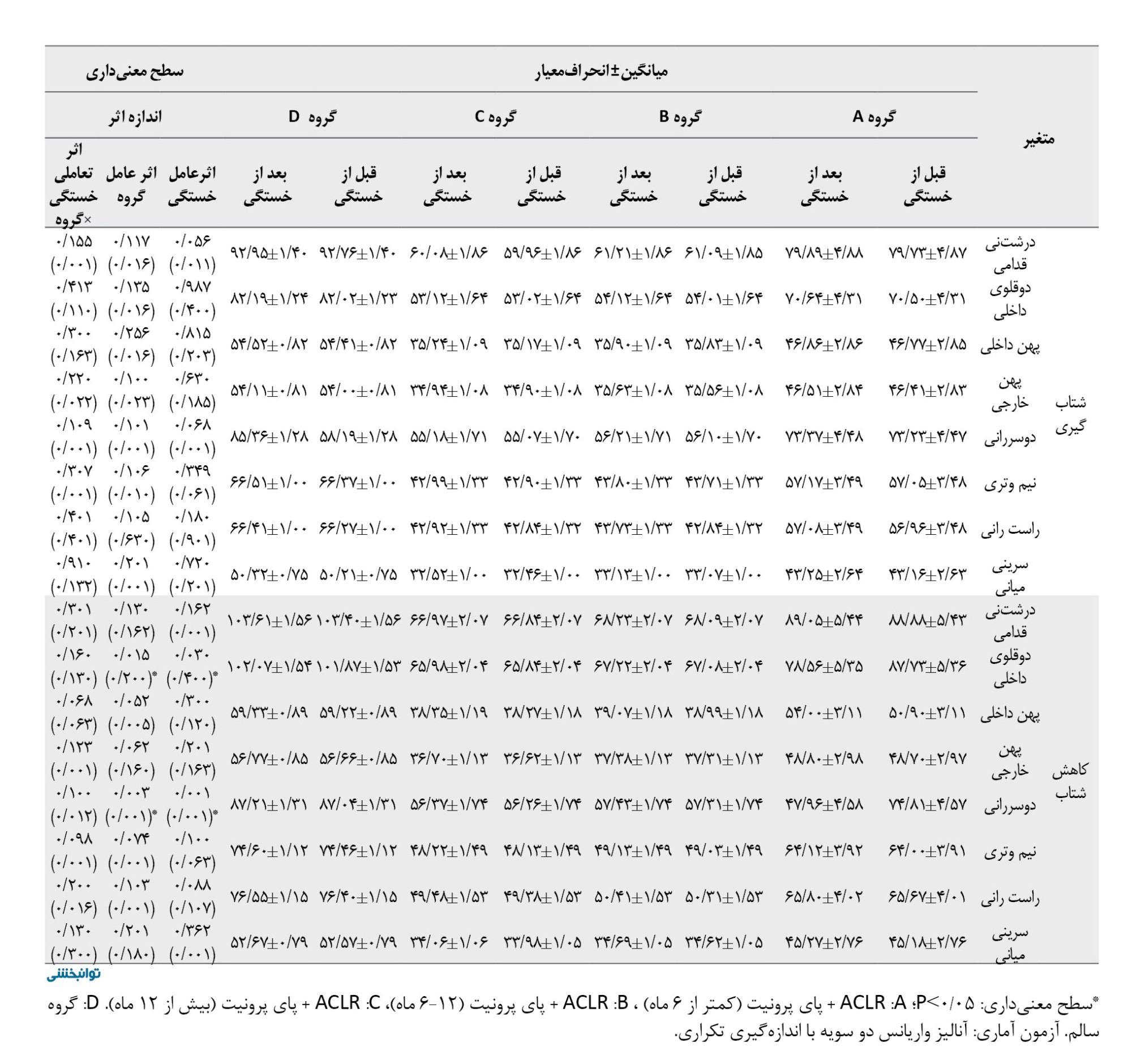
همچنین اثر عامل خستگی برای عضلات دوقلوی داخلی (0/400=d؛ 0/030=P) و دوسرانی (0/001=d؛ 0/001=P) طی فاز کاهش شتاب ازلحاظ آماری معنادار بود. بهعلاوه اثر عامل گروه کاهش معناداری برای طیف فرکانس فعالیت الکتریکی عضلات دوقلوی داخلی (0/200=d؛ 0/015=P) و دوسررانی (0/001=d؛ 0/003=P) در فاز کاهش شتاب نشان داد. یافتهها هیچ تأثیر معناداری برای اثر تعاملی خستگی×گروه برای عضلات اندام تحتانی در فازهای مختلف دویدن نشان نداد.
براساس جدول شماره 3، اثر عامل خستگی ازلحاظ آماری برای عضله درشتنی قدامی (0/028=d؛ 0/008=P)، و عضله دوسررانی (0/240=d؛ 0/049=P) طی فاز بارگذاری، همچنین عضلات درشتنی قدامی (0/041=d؛ 0/002=P)، دوقلوی داخلی (0/222=d؛ 0/015=P)، پهن داخلی (0/019=d؛ 0/038=P)، پهن خارجی (0/019=d؛ 0/036=P)، و دوسررانی (0/029=d؛ 0/006=P)، طی فاز میانه اتکا و عضلات پهن داخلی (0/018=d؛ 0/042=P)، پهن خارجی (0/009=d؛ 0/039=P)، و سرینی میانی (0/009=d؛ 0/035=P)، طی فاز کاهش شتاب و عضله سرینی میانی طی فاز شتابگیری معنادار بود (0/019=d؛ 0/035=P). همچنین اثر عامل گروه برای عضله درشتنی قدامی (0/021=d؛ 0/035=P)، و دوقلوی داخلی (0/025=d؛ 0/020=P)، طی فاز بارگذاری و سرینی میانی در فاز میانه اتکا ازلحاظ آماری معنادار بود (0/260=d؛ 0/018=P).
یافتهها نشان داد اثر تعاملی خستگی×گروه برای عضله دوسررانی در فاز پاسخ بارگذاری (0/200=d؛ 0/038=P)، عضله سرینی میانی در فاز میانه اتکا (0/019=d؛ 0/048=P) ازلحاظ آماری معنادار بود. نتایج تست تعقیبی نشان داد بیشترین نرخ افزایش مربوط به گروه بازسازی ACL کمتر از 6 ماه در مقایسه با سایر گروهها بود.
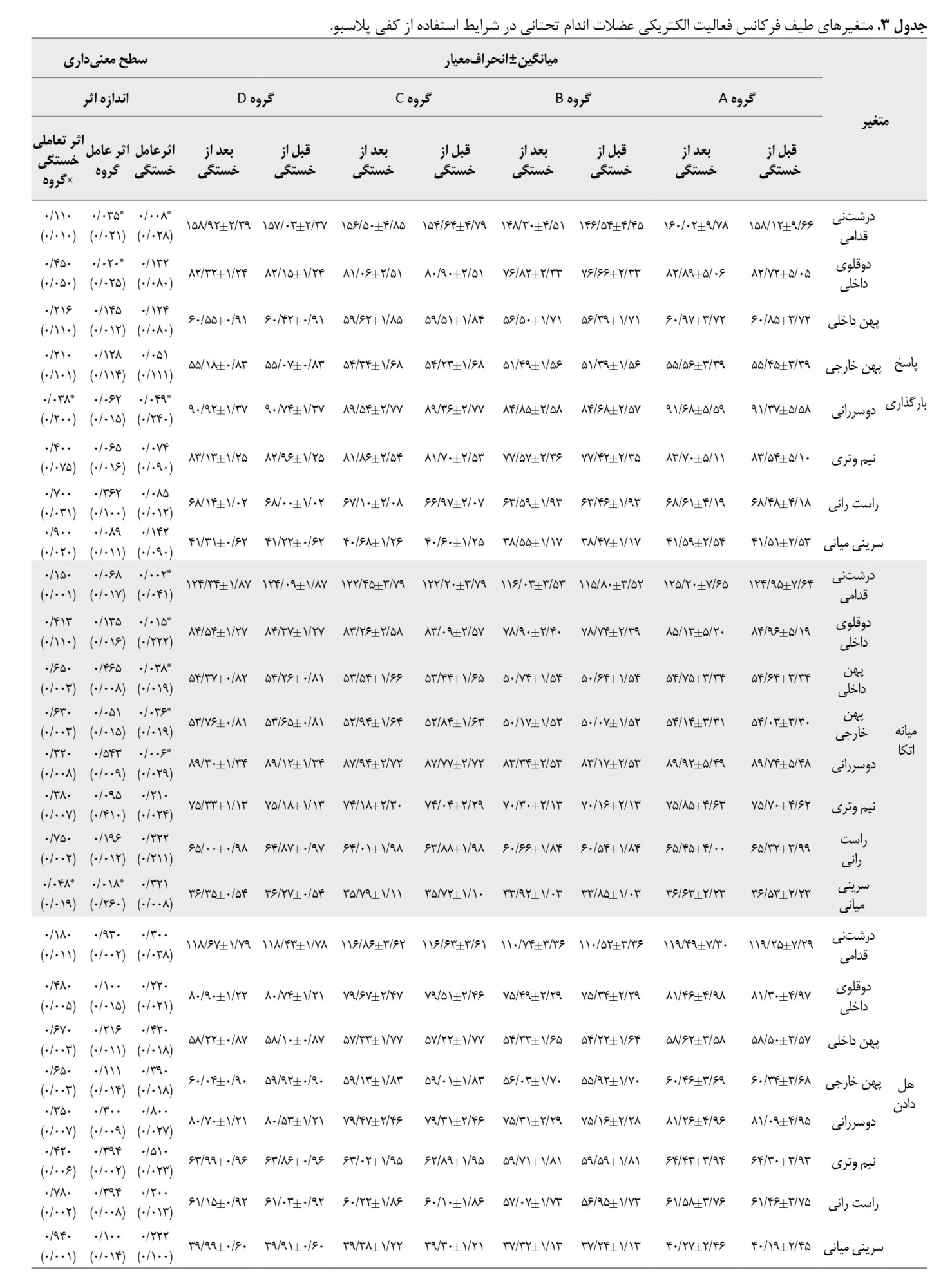
براساس جدول شماره 4، اثر عامل خستگی ازلحاظ آماری برای عضله درشتنی قدامی (0/018=d؛ 0/040=P)، و دوسررانی (0/020=d؛ 0/030=P)، طی فاز بارگذاری، عضله درشتنی قدامی (0/021=d؛ 0/022=P)، دوقلوی داخلی (0/025=d؛ 0/010=P)، دوسررانی (0/024=d؛ 0/012=P) و نیموتری (0/022=d؛ 0/025=P) در فاز میانه اتکا، عضلات درشتنی قدامی (0/019=d؛ 0/035=P)، دوقلوی داخلی (0/021=d؛ 0/028=P)، دوسررانی (0/022=d؛ 0/025=P)، و نیموتری (0/020=d؛ 0/032=P)، طی فاز هل دادان معنادار بود.
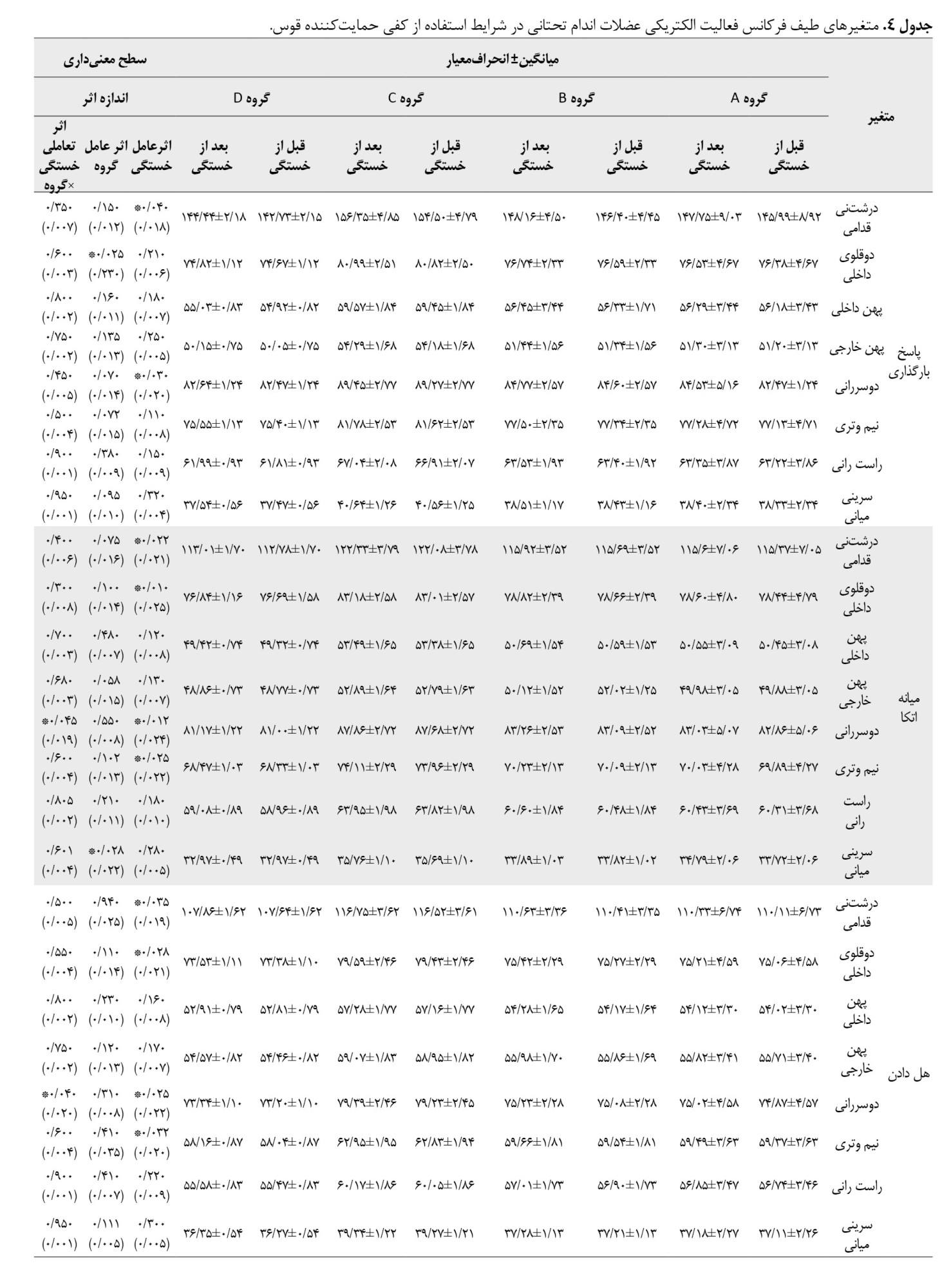
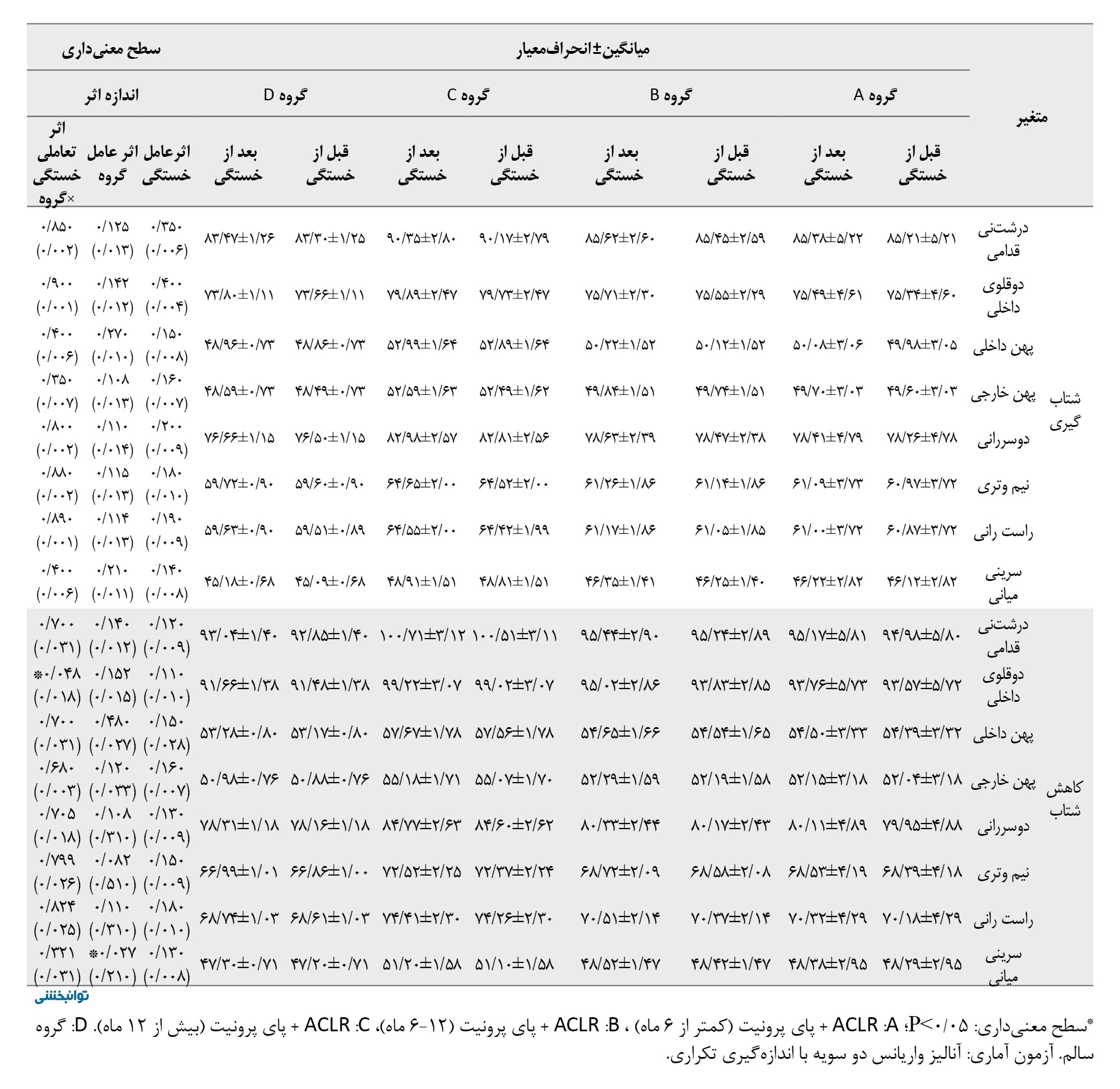
همچنین اثر عامل گروه برای عضله دوقلوی داخلی طی فاز بارگذاری (0/230=d؛ 0/025=P)، سرینی میانی طی فاز میانه اتکا (0/022=d؛ 0/028=P) و کاهش شتابگیری (0/210=d؛ 0/027=P)، ازلحاظ آماری معنادار بود. یافتهها نشان داد اثر تعاملی خستگی×گروه برای عضله دوسررانی در فاز میانه اتکا (0/019=d؛ 0/045=P)، و فاز هلدادن (0/020=d؛ 0/040=P) ازلحاظ آماری افزایش معناداری داشت. همچنین یافتهها نشان داد اثر تعاملی خستگی×گروه برای عضله دوقلوی داخلی در فاز کاهش شتابگیری ازلحاظ آماری معنادار بود (0/018=d؛ 0/048=P). نتایج تست تعقیبی نشان داد بیشترین نرخ افزایش برای عضله دوسررانی در فاز میانه اتکا و هل دادن مربوط به گروه بازسازی ACL کمتر از 6 ماه بود، درحالیکه بیشترین مقدار افزایش طیف فرکانس فعالیت الکتریکی عضله دوقلوی داخلی طی فاز کاهش شتاب مربوط به گروه بازسازی ACL کمتر از 12 ماه بود.
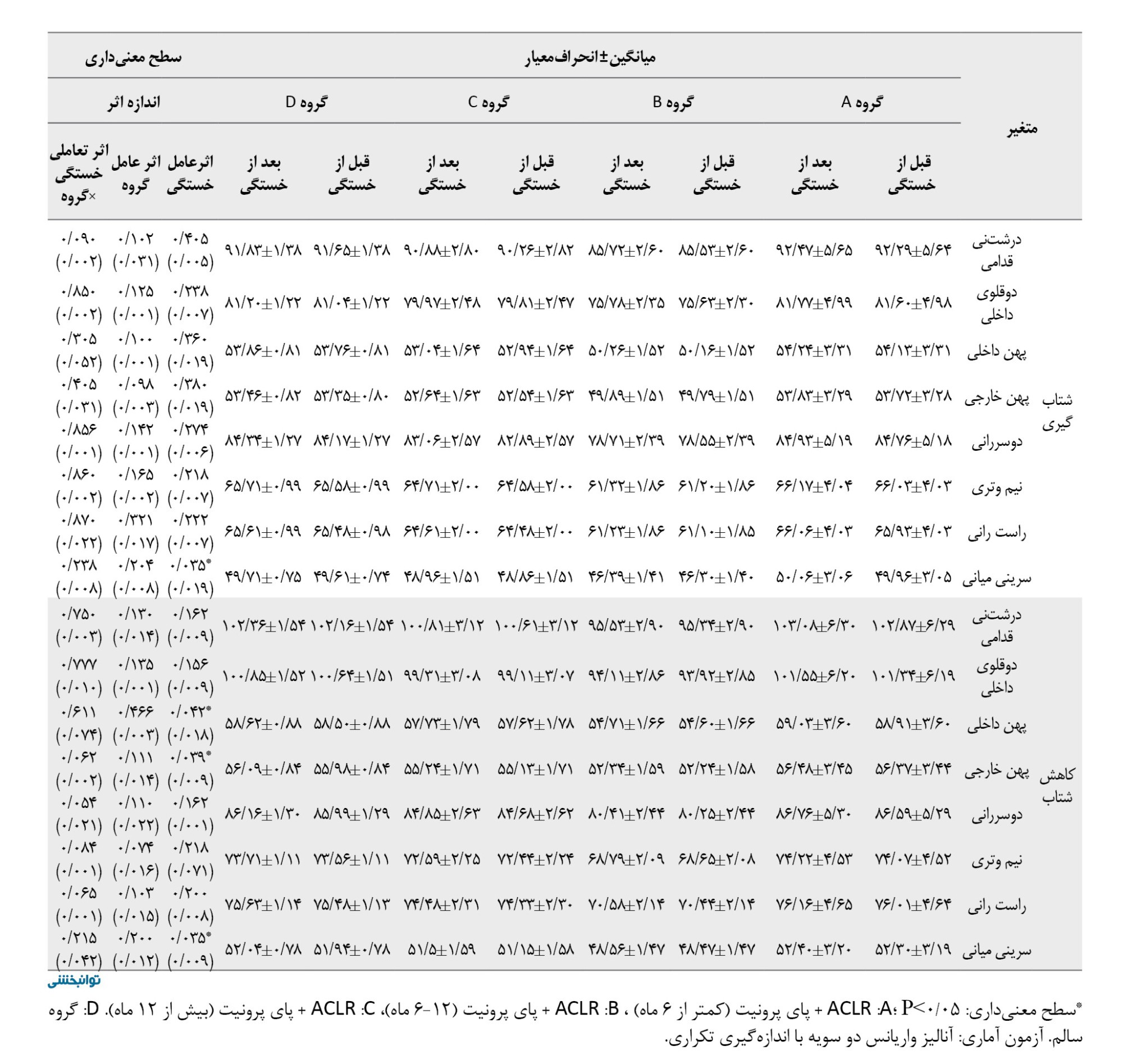
براساس جدول شماره 5، اثر عامل خستگی ازلحاظ آماری برای عضله دوقلوی داخلی (0/017=d؛ 0/045=P)، طی فاز بارگذاری، عضله دوقلوی داخلی 0/023=d؛ 0/018=P)، پهن داخلی (0/027=d؛ 0/038=P)، پهن خارجی (0/019=d؛ 0/030=P)، و سرینی میانی (0/200=d؛ 0/029=P) در فاز میانه اتکا، عضله دوقلوی داخلی (0/210=d؛ 0/028=P) و عضله سرینی میانی طی فاز هل دادن معنادار بود (0/291=d؛ 0/021=P).
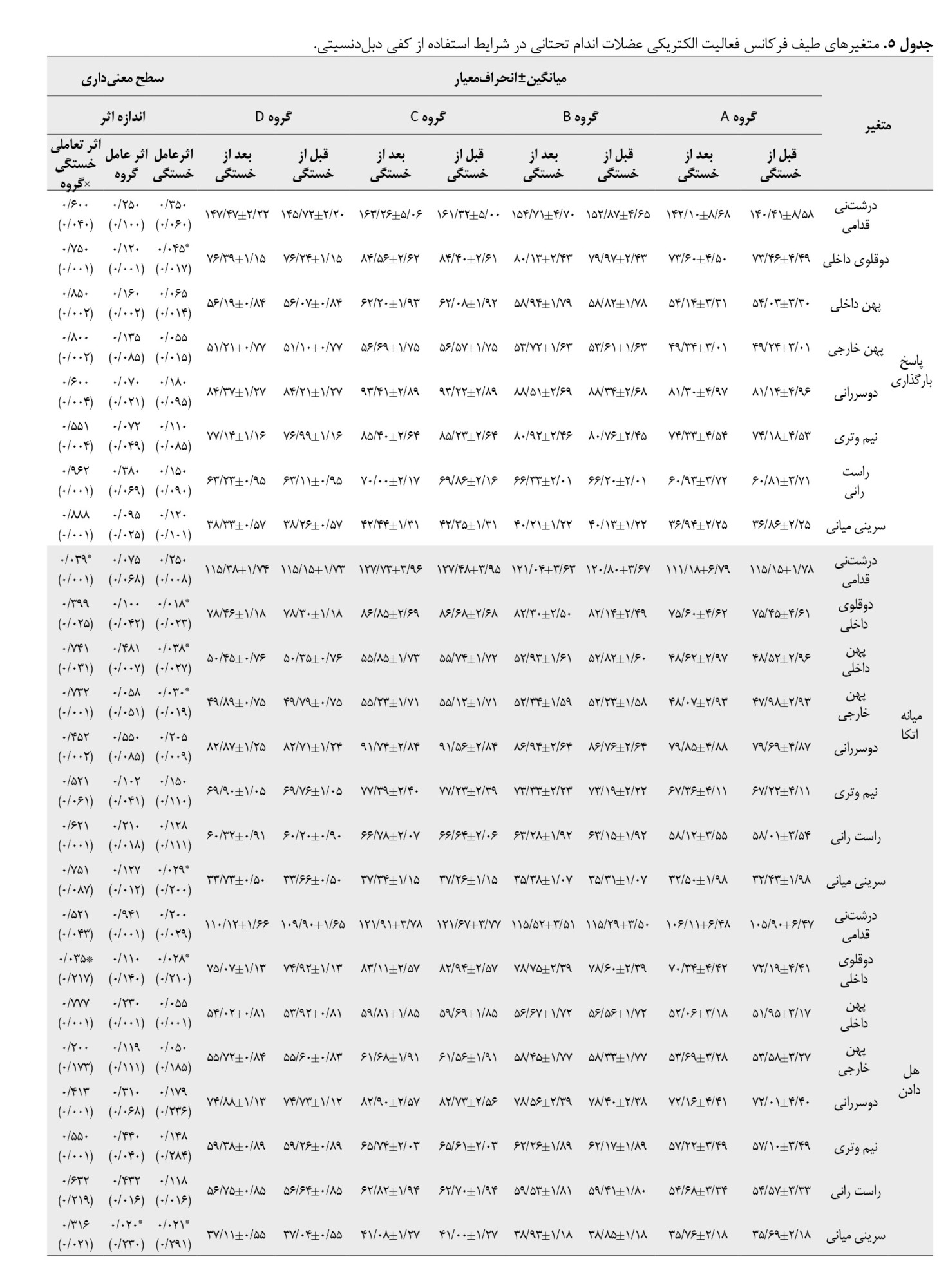
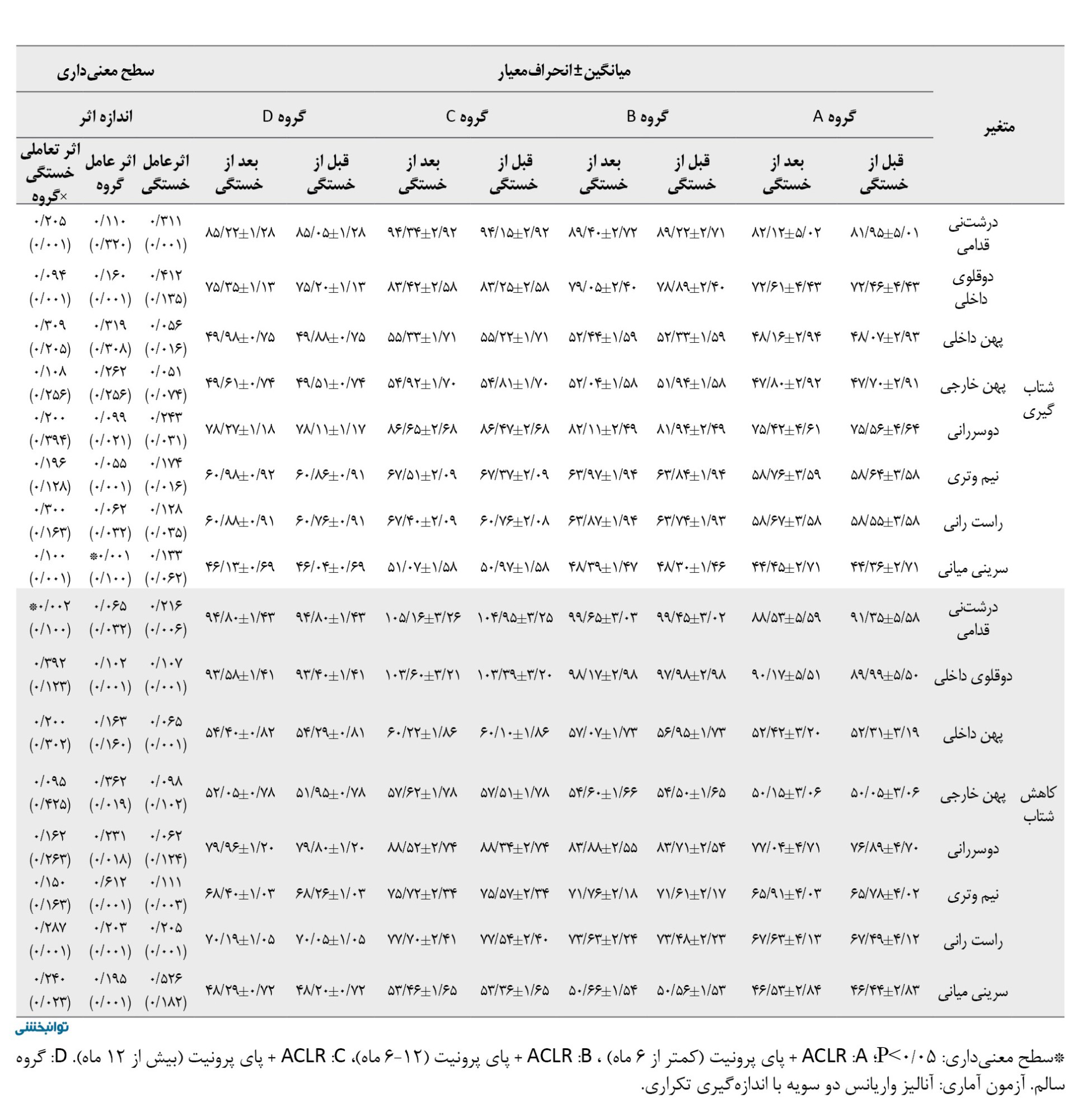
همچنین اثر عامل گروه برای عضله سرینی میانی طی فاز هل دادن (0/230=d؛ 0/020=P)، و شتابگیری ازلحاظ آماری معنادار بود (0/100=d؛ 0/001=P).
یافتهها نشان داد اثر تعاملی خستگی×گروه برای عضله درشتنی قدامی طی فاز میانه اتکا (0/001=d؛ 0/039=P)، دوقلوی داخلی طی فاز هلدادن (0/217=d؛ 0/035=P)، و درشتنی قدامی طی فاز کاهش شتاب (0/100=d؛ 0/002=P) ازلحاظ آماری کاهش معناداری داشت. نتایج تست تعقیبی نشان داد بیشترین نرخ کاهش مربوط به گروه بازسازی ACL کمتر از 6 ماه در مقایسه با سایر گروهها بود.
بحث
هدف از این مطالعه، بررسی اثر انواع کفی و خستگی بر طیف فرکانس فعالیت الکتریکی عضلات اندام تحتانی در افراد دارای بازسازی رباط صلیبی قدامی و پای پرونیت در بازههای زمانی 6، 12 و 18 ماه پس از جراحی طی دویدن بود.
شرایط کفش کنترل
مشاهده افزایش طیف فرکانس عضله درشتنی قدامی در پاسخ به خستگی، میتواند نشاندهنده یک استراتژی جبرانی عصبی-عضلانی باشد [36]. معمولاً انتظار میرود خستگی بهدلیل عواملی مانند اسیدوز متابولیک و کاهش سرعت هدایت عصبی، به کاهش طیف فرکانس فعالیت الکتریکی عضلات منجر شود. بااینحال، افزایش مشاهدهشده در این مطالعه را میتوان به فعالسازی ترجیحی واحدهای حرکتی تندانقباض نسبت داد. تحت شرایط خستگی، کارایی فیبرهای کندانقباض کاهش یافته و سیستم عصبی مرکزی برای حفظ سطح عملکرد و ثبات مفصل، به ناچار واحدهای حرکتی بزرگتر و سریعانقباض را با نرخ تخلیه عصبی بالاتر بسیج میکند که این امر در سیگنال فعالیت الکتریکی عضلات بهصورت افزایش مؤلفههای طیف فرکانسی بالاتر مشاهده میشود [14، 15].
این یافته با مطالعه جعفرنژادگرو و همکاران همسو است که گزارش کردند خستگی میتواند الگوی فعالیت عضلات همسترینگ را در حین فعالیتهای پویا تغییر دهد [17]. به نظر میرسد خستگی با کاهش کارایی واحدهای حرکتی و نیاز به بسیج واحدهای تندانقباض بیشتر، به افزایش مؤلفههای فرکانس بالاتر در سیگنال فعالیت الکتریکی عضلات منجر میشود. این مکانیسم جبرانی اگرچه در کوتاهمدت برای مقابله با بیثباتی و جذب شوک ضروری است، اما در بلندمدت میتواند با تغییر الگوی حرکتی بهینه، فرد را مستعد آسیبهایی نظیر سندرم کمپارتمان قدامی یا درد ساق پا کند [37، 38].
براساس یافتهها، در گروه با بازسازی ACL، طیف فرکانس فعالیت الکتریکی عضله دوسررانی در فاز کاهش شتاب کاهش چشمگیری داشت. براساس مطالعههای گذشته این عضله طی دویدن طی فاز نوسان به شدت فعال است تا از حرکت بیش از حد درشتنی به جلو روی ران (که باعث کشش ACL میشود) جلوگیری کند [39]. کاهش فعالیت یا تغییر الگوی فرکانسی این عضله پس از خستگی بسیار نگرانکننده تلقی میشود. این امر نشان میدهد خستگی میتواند مکانیسم محافظتی همسترینگ را تضعیف کند و بیماران را بهویژه در مراحل اولیه بهبودی (کمتر از ۶ ماه)، در معرض خطر بالاتر آسیبهای مجدد قرار دهد. در همین راستا فونتنای و همکاران [40] اظهار کردند خستگی بهعنوان یک عامل تشدیدکننده عدم تقارن و مکانیسم محافظتی زانو را بهطور خاص در مراحل اولیه بهبودی (کمتر از 6 ماه) در معرض خطر قرار میدهد.
کفی پلاسبو
بیشترین نرخ افزایش طیف فرکانس فعالیت الکتریکی عضلات، مربوط به عضلات دوسررانی در فاز بارگذاری و سرینی میانی در فاز اتکا مشاهده شد که در گروه بیماران با بازسازی ACL زیر 6 ماه، بهطور معناداری بالاتر از سایر گروهها بود. از دیدگاه بیومکانیکی، عضله دوسررانی در فاز بارگذاری دویدن، از طریق انقباض برونگرا، نقش محوری در کنترل حرکت پیشرونده ساق پا و اعمال نیروهای مهارکننده قدامی بر روی مفصل زانو ایفا میکند [41].
ازآنجاکه ACL نقش اصلی در مهار این جابهجایی دارد، بدن پس از آسیب، با یک مکانیسم جبرانی-حفاظتی، مانند فعالتر کردن عضله دوسررانی، سعی در جایگزینی عملکرد رباط آسیبدیده و حفظ پایداری دینامیک زانو دارد. همزمان، فعالیت بیشتر عضله سرینی میانی در فاز اتکا، نشاندهنده تلاش سیستم عصبی-عضلانی برای کنترل پایداری لگن است. احتمالاً این الگوی فعالسازی مضاعف در بیماران با سابقه عمل کمتر از 6 ماه، احتمالاً بازتابی از حداکثر تلاش سیستم عصبی مرکزی برای استفاده از مکانیسمهای جبرانی و بازآموزی الگوی حرکتی بهینه در مراحل اولیه بازگشت به فعالیتهای پویا مانند دویدن است. این پدیده میتواند نشاندهنده درجه بالاتری از نوروپلاستیسیته و تطابق عصبی-عضلانی در این بازه زمانی خاص باشد. اگرچه این تغییرات از نظر آماری معنادار بودند، اما اندازه اثر محاسبهشده برای این تعاملات در بسیاری از موارد کوچک بود. این موضوع نشان میدهد الگوی تغییرات جهتدار و قابلتفسیر است، اما میزان این تغییرات از نظر بزرگی محدود میباشد و ممکن است اهمیت بالینی فوری و چشمگیری نداشته باشد. بااینحال، شناسایی همین تغییرات ظریف در مراحل اولیه بهبودی میتواند بهعنوان یک شاخص حساس از استراتژیهای جبرانی سیستم عصبی-عضلانی در نظر گرفته شود که در صورت تداوم، پتانسیل تأثیرگذاری بر مکانیک دویدن در بلندمدت را دارند.
کفی حمایتکننده قوس
تحلیل یافتهها حاکی از آن است که الگوی بهبود عصبی-عضلانی در گروههای مختلف زمانی پس از بازسازی ACL از روندهای متمایزی پیروی میکند. در بیماران با سابقه عمل کمتر از 6 ماه، بارزترین بهبود در فعالیت عضله دوسررانی طی فازهای میانه اتکا و هلدادن مشاهده گردید. این الگو منطبق را میتوان بهعنوان یک استراتژی جبرانی اولیه سیستم عصبی-عضلانی تفسیر کرد که در مراحل اولیه بازگشت به فعالیت، بر ثبات دینامیک مفصل زانو از طریق تقویت عضلات همسترینگ تأکید دارد [42]. با افزایش مدتزمان پس از جراحی، این الگو تکامل مییابد. در گروه با سابقه عمل 6-12 ماه، بیشترین بهبود در فعالیت عضله دوقلوی داخلی طی فاز کاهش شتاب ثبت شد. این تغییر، نشاندهنده تغییر تدریجی کانون توجه سیستم کنترل حرکتی از ثبات مفصل زانو به سمت بهبود کنترل نوسانات مرکز ثقل و پایداری پوسچرال در طول چرخه گامبرداری است [43].
استفاده از کفی حمایتکننده قوس به افزایش معنادار فعالیت الکتریکی عضله سرینی میانی در فاز میانه اتکا منجر شد. این عضله که اصلیترین تثبیتکننده لگن در صفحه فرونتال محسوب میشود، با ضعف خود موجب افزایش چرخش داخلی ران و استرس بر ACL میشود. کفی حمایتکننده قوس با ایجاد تکیهگاه ساختاریافته برای قوس طولی داخلی پا، سرعت و دامنه پرونیشن را در فاز میانه اتکا کاهش داده و درنتیجه زنجیره جنبشی بالاتر را تحت تأثیر قرار میدهند. این تغییرات سیستم عصبی-عضلانی را قادر میسازد تا فعالسازی عضله سرینی میانی را بهعنوان اصلیترین تثبیتکننده لگن بهینهسازی کند [44]. یافتههای کفی حمایتکننده قوس پا در مقایسه با شرایط کفی پلاسبو نیز قابلمشاهده است. در شرایط پلاسبو، اثر خستگی بر الگوی فعالیت عضله دوقلوی داخلی بهوضوح مشهود بود، درحالیکه این اثر تحت شرایط استفاده از کفی حمایتکننده قوس بهطور محسوسی تعدیل یافت. به نظر میرسد این کفیها نهتنها با کاهش بار مکانیکی مستقیم، بلکه از طریق ارائه ورودیهای حسی-عمقی بهبودیافته، هماهنگی عصبی-عضلانی را حتی در شرایط خستگی تسهیل میکنند.
کفی دبلدنسیتی
این کفی با طراحی دوگانه خود، نهتنها از قوس حمایت میکند، بلکه یک سیگنال حسی-عمقی قویتر و کنترل فعالتری روی پرونیشن ایجاد میکند. تأثیر معنادار عضلات پهن داخلی و خارجی در فاز میانه اتکا پس از خستگی نشان میدهد که با وجود حمایت کفی دبلدنسیتی، عضلات چهارسر ران همچنان تحت فشار است. این میتواند به این دلیل باشد که این کفی با بهبود راستا، اجازه میدهد فرد با کارایی بالاتری بدود و درنتیجه از عضلات چهارسر خود بیشتر استفاده کند که نهایتاً به خستگی آنها منجر میشود. این یافته احتمالاً نشاندهنده عادیسازی الگوی دویدن و فعالسازی عضلانی باشد [45]. در این راستا ارکان و همکاران، نشان دادند کفیهای اصلاحی به افزایش معنادار فعالیت الکترومیوگرافی عضلات پهن داخلی و خارجی در فاز اتکا منجر میشوند که همسو با عادیسازی الگوی عضلانی و افزایش بارکاری عضلات چهارسر ران است [46].
نتیجهگیری
بهنظر میرسد خستگی و هماستفاده از کفیهای مختلف میتوانند الگوی فعالیت عصبی-عضلانی را در افراد با بازسازی ACL و پای پرونیت تغییر دهند. در بین کفیهای موردبررسی، کفیهای تخصصیتر مانند کفی حمایتکننده قوس و کفی دبلدنسیتی پتانسیل بیشتری در تعدیل اثرات منفی خستگی و بهبود الگوی فعالیت عضلات، بهویژه در بیماران در مراحل اولیه پس از جراحی (کمتر از ۶ ماه)، نشان دادند.
از محدودیتهای پژوهش حاضر میتوان به عدم بررسی جنسیت بانوان، و عدم بررسی بلندمدت استفاده از کفی اشاره نمود. لذا پیشنهاد میشود در مطالعات آینده با در نظر گرفتن محدودیتهای این مطالعه، مطالعههایی با هدف رفع این محدودیتها انجام شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه دارای کد اخلاق به شماره (IR.UMA.REC.1404.019) از دانشگاه محقق اردبیلی و کد کارآزمایی بالینی از مرکز ثبت کارآزمایی بالینی ایران (IRCT20220129053865N2) است.
حامی مالی
این مطالعه برگرفته از رساله دکتری ابراهیم پیری از دانشگاه محقق اردبیلی میباشد و هیچگونه کمک مالی از سازمانیهای دولتی، خصوصی و غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
همه نویسندگان بهطور یکسان در مفهوم و طراحی مطالعه، جمعآوری و تجزیهوتحلیل دادهها، تفسیر نتایج و تهیه پیشنویس مقاله مشارکت داشتند.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان مطالعه حاضر از شرکتکنندگان در مطالعه حاضر سپاسگزاری میکنند.
پروتکل خستگی برای آزمودنیها با استفاده از تردمیل پیشرفته مدل (Horizon Fitness, Omega GT, USA) بدون شیب انجام شد. در هنگام شروع آزمودنیها درحالیکه با سرعت 6 کیلومتر در ساعت راه میرفتند، پروتکل را شروع کردند و سرعت تردمیل هر 2 دقیقه 1 کیلومتر در ساعت افزایش یافت. از مقیاسی ادراکی بورگ (6-20) جهت تعیین لحظه نهایی خستگی شرکتکنندگان استفاده شد [34]. به محض اینکه شرکتکنندگان ادراک 13 یا بالاتر را در مقیاس بورگ گزارش کردند، سرعت تردمیل ثابت شد تا اجازه دویدن در حالت ثابت را بدهد. در طول مرحله دویدن در حالت پایدار، امتیاز تلاش درکشده هر 30 ثانیه ارزیابی میشد و پروتکل خستگی پس از 2 دقیقه دویدن در حالت پایدار بیش از 17 در مقیاس 6 تا 20 بورگ یا 80 درصد حداکثر ضربان قلب یه پایان میرسید [35].
تجزیه و تحلیل آماری
نرمال بودن دادهها با استفاده از آزمون شاپیرو-ویلک تأیید شد. از آزمون آنالیز واریانس دوسویه با اندازهگیریهای تکراری استفاده شد. تمام تحلیلها در سطح معنیداری 05/P<0 و با استفاده از نرمافزار SPSS نسخه 23 انجام پذیرفت. برای بررسی همگنی از آزمون لون در سطح معنیداری برابر با 0/05≥P استفاده شد. تمام تجزیهوتحلیل آماری با استفاده از نرمافزار اکسل و نرمافزار SPSS نسخه 23 انجام شد [32].
یافتهها
طیف فرکانس فعالیت الکتریکی عضلات اندام تحتانی طی فازهای مختلف دویدن بین پیشآزمون گروههای موردمطالعه هیچ تفاوت معنیداری نداشت (05/P>0). براساس جدول شماره 2، اثر عامل خستگی ازلحاظ آماری برای عضله درشتنی قدامی طی فاز بارگذاری (0/215=d؛ 0/024=P)، و هل دادن معنادار بود (0/200=d؛ 0/003=P).


همچنین اثر عامل خستگی برای عضلات دوقلوی داخلی (0/400=d؛ 0/030=P) و دوسرانی (0/001=d؛ 0/001=P) طی فاز کاهش شتاب ازلحاظ آماری معنادار بود. بهعلاوه اثر عامل گروه کاهش معناداری برای طیف فرکانس فعالیت الکتریکی عضلات دوقلوی داخلی (0/200=d؛ 0/015=P) و دوسررانی (0/001=d؛ 0/003=P) در فاز کاهش شتاب نشان داد. یافتهها هیچ تأثیر معناداری برای اثر تعاملی خستگی×گروه برای عضلات اندام تحتانی در فازهای مختلف دویدن نشان نداد.
براساس جدول شماره 3، اثر عامل خستگی ازلحاظ آماری برای عضله درشتنی قدامی (0/028=d؛ 0/008=P)، و عضله دوسررانی (0/240=d؛ 0/049=P) طی فاز بارگذاری، همچنین عضلات درشتنی قدامی (0/041=d؛ 0/002=P)، دوقلوی داخلی (0/222=d؛ 0/015=P)، پهن داخلی (0/019=d؛ 0/038=P)، پهن خارجی (0/019=d؛ 0/036=P)، و دوسررانی (0/029=d؛ 0/006=P)، طی فاز میانه اتکا و عضلات پهن داخلی (0/018=d؛ 0/042=P)، پهن خارجی (0/009=d؛ 0/039=P)، و سرینی میانی (0/009=d؛ 0/035=P)، طی فاز کاهش شتاب و عضله سرینی میانی طی فاز شتابگیری معنادار بود (0/019=d؛ 0/035=P). همچنین اثر عامل گروه برای عضله درشتنی قدامی (0/021=d؛ 0/035=P)، و دوقلوی داخلی (0/025=d؛ 0/020=P)، طی فاز بارگذاری و سرینی میانی در فاز میانه اتکا ازلحاظ آماری معنادار بود (0/260=d؛ 0/018=P).


یافتهها نشان داد اثر تعاملی خستگی×گروه برای عضله دوسررانی در فاز پاسخ بارگذاری (0/200=d؛ 0/038=P)، عضله سرینی میانی در فاز میانه اتکا (0/019=d؛ 0/048=P) ازلحاظ آماری معنادار بود. نتایج تست تعقیبی نشان داد بیشترین نرخ افزایش مربوط به گروه بازسازی ACL کمتر از 6 ماه در مقایسه با سایر گروهها بود.
براساس جدول شماره 4، اثر عامل خستگی ازلحاظ آماری برای عضله درشتنی قدامی (0/018=d؛ 0/040=P)، و دوسررانی (0/020=d؛ 0/030=P)، طی فاز بارگذاری، عضله درشتنی قدامی (0/021=d؛ 0/022=P)، دوقلوی داخلی (0/025=d؛ 0/010=P)، دوسررانی (0/024=d؛ 0/012=P) و نیموتری (0/022=d؛ 0/025=P) در فاز میانه اتکا، عضلات درشتنی قدامی (0/019=d؛ 0/035=P)، دوقلوی داخلی (0/021=d؛ 0/028=P)، دوسررانی (0/022=d؛ 0/025=P)، و نیموتری (0/020=d؛ 0/032=P)، طی فاز هل دادان معنادار بود.


همچنین اثر عامل گروه برای عضله دوقلوی داخلی طی فاز بارگذاری (0/230=d؛ 0/025=P)، سرینی میانی طی فاز میانه اتکا (0/022=d؛ 0/028=P) و کاهش شتابگیری (0/210=d؛ 0/027=P)، ازلحاظ آماری معنادار بود. یافتهها نشان داد اثر تعاملی خستگی×گروه برای عضله دوسررانی در فاز میانه اتکا (0/019=d؛ 0/045=P)، و فاز هلدادن (0/020=d؛ 0/040=P) ازلحاظ آماری افزایش معناداری داشت. همچنین یافتهها نشان داد اثر تعاملی خستگی×گروه برای عضله دوقلوی داخلی در فاز کاهش شتابگیری ازلحاظ آماری معنادار بود (0/018=d؛ 0/048=P). نتایج تست تعقیبی نشان داد بیشترین نرخ افزایش برای عضله دوسررانی در فاز میانه اتکا و هل دادن مربوط به گروه بازسازی ACL کمتر از 6 ماه بود، درحالیکه بیشترین مقدار افزایش طیف فرکانس فعالیت الکتریکی عضله دوقلوی داخلی طی فاز کاهش شتاب مربوط به گروه بازسازی ACL کمتر از 12 ماه بود.
براساس جدول شماره 5، اثر عامل خستگی ازلحاظ آماری برای عضله دوقلوی داخلی (0/017=d؛ 0/045=P)، طی فاز بارگذاری، عضله دوقلوی داخلی 0/023=d؛ 0/018=P)، پهن داخلی (0/027=d؛ 0/038=P)، پهن خارجی (0/019=d؛ 0/030=P)، و سرینی میانی (0/200=d؛ 0/029=P) در فاز میانه اتکا، عضله دوقلوی داخلی (0/210=d؛ 0/028=P) و عضله سرینی میانی طی فاز هل دادن معنادار بود (0/291=d؛ 0/021=P).


همچنین اثر عامل گروه برای عضله سرینی میانی طی فاز هل دادن (0/230=d؛ 0/020=P)، و شتابگیری ازلحاظ آماری معنادار بود (0/100=d؛ 0/001=P).
یافتهها نشان داد اثر تعاملی خستگی×گروه برای عضله درشتنی قدامی طی فاز میانه اتکا (0/001=d؛ 0/039=P)، دوقلوی داخلی طی فاز هلدادن (0/217=d؛ 0/035=P)، و درشتنی قدامی طی فاز کاهش شتاب (0/100=d؛ 0/002=P) ازلحاظ آماری کاهش معناداری داشت. نتایج تست تعقیبی نشان داد بیشترین نرخ کاهش مربوط به گروه بازسازی ACL کمتر از 6 ماه در مقایسه با سایر گروهها بود.
بحث
هدف از این مطالعه، بررسی اثر انواع کفی و خستگی بر طیف فرکانس فعالیت الکتریکی عضلات اندام تحتانی در افراد دارای بازسازی رباط صلیبی قدامی و پای پرونیت در بازههای زمانی 6، 12 و 18 ماه پس از جراحی طی دویدن بود.
شرایط کفش کنترل
مشاهده افزایش طیف فرکانس عضله درشتنی قدامی در پاسخ به خستگی، میتواند نشاندهنده یک استراتژی جبرانی عصبی-عضلانی باشد [36]. معمولاً انتظار میرود خستگی بهدلیل عواملی مانند اسیدوز متابولیک و کاهش سرعت هدایت عصبی، به کاهش طیف فرکانس فعالیت الکتریکی عضلات منجر شود. بااینحال، افزایش مشاهدهشده در این مطالعه را میتوان به فعالسازی ترجیحی واحدهای حرکتی تندانقباض نسبت داد. تحت شرایط خستگی، کارایی فیبرهای کندانقباض کاهش یافته و سیستم عصبی مرکزی برای حفظ سطح عملکرد و ثبات مفصل، به ناچار واحدهای حرکتی بزرگتر و سریعانقباض را با نرخ تخلیه عصبی بالاتر بسیج میکند که این امر در سیگنال فعالیت الکتریکی عضلات بهصورت افزایش مؤلفههای طیف فرکانسی بالاتر مشاهده میشود [14، 15].
این یافته با مطالعه جعفرنژادگرو و همکاران همسو است که گزارش کردند خستگی میتواند الگوی فعالیت عضلات همسترینگ را در حین فعالیتهای پویا تغییر دهد [17]. به نظر میرسد خستگی با کاهش کارایی واحدهای حرکتی و نیاز به بسیج واحدهای تندانقباض بیشتر، به افزایش مؤلفههای فرکانس بالاتر در سیگنال فعالیت الکتریکی عضلات منجر میشود. این مکانیسم جبرانی اگرچه در کوتاهمدت برای مقابله با بیثباتی و جذب شوک ضروری است، اما در بلندمدت میتواند با تغییر الگوی حرکتی بهینه، فرد را مستعد آسیبهایی نظیر سندرم کمپارتمان قدامی یا درد ساق پا کند [37، 38].
براساس یافتهها، در گروه با بازسازی ACL، طیف فرکانس فعالیت الکتریکی عضله دوسررانی در فاز کاهش شتاب کاهش چشمگیری داشت. براساس مطالعههای گذشته این عضله طی دویدن طی فاز نوسان به شدت فعال است تا از حرکت بیش از حد درشتنی به جلو روی ران (که باعث کشش ACL میشود) جلوگیری کند [39]. کاهش فعالیت یا تغییر الگوی فرکانسی این عضله پس از خستگی بسیار نگرانکننده تلقی میشود. این امر نشان میدهد خستگی میتواند مکانیسم محافظتی همسترینگ را تضعیف کند و بیماران را بهویژه در مراحل اولیه بهبودی (کمتر از ۶ ماه)، در معرض خطر بالاتر آسیبهای مجدد قرار دهد. در همین راستا فونتنای و همکاران [40] اظهار کردند خستگی بهعنوان یک عامل تشدیدکننده عدم تقارن و مکانیسم محافظتی زانو را بهطور خاص در مراحل اولیه بهبودی (کمتر از 6 ماه) در معرض خطر قرار میدهد.
کفی پلاسبو
بیشترین نرخ افزایش طیف فرکانس فعالیت الکتریکی عضلات، مربوط به عضلات دوسررانی در فاز بارگذاری و سرینی میانی در فاز اتکا مشاهده شد که در گروه بیماران با بازسازی ACL زیر 6 ماه، بهطور معناداری بالاتر از سایر گروهها بود. از دیدگاه بیومکانیکی، عضله دوسررانی در فاز بارگذاری دویدن، از طریق انقباض برونگرا، نقش محوری در کنترل حرکت پیشرونده ساق پا و اعمال نیروهای مهارکننده قدامی بر روی مفصل زانو ایفا میکند [41].
ازآنجاکه ACL نقش اصلی در مهار این جابهجایی دارد، بدن پس از آسیب، با یک مکانیسم جبرانی-حفاظتی، مانند فعالتر کردن عضله دوسررانی، سعی در جایگزینی عملکرد رباط آسیبدیده و حفظ پایداری دینامیک زانو دارد. همزمان، فعالیت بیشتر عضله سرینی میانی در فاز اتکا، نشاندهنده تلاش سیستم عصبی-عضلانی برای کنترل پایداری لگن است. احتمالاً این الگوی فعالسازی مضاعف در بیماران با سابقه عمل کمتر از 6 ماه، احتمالاً بازتابی از حداکثر تلاش سیستم عصبی مرکزی برای استفاده از مکانیسمهای جبرانی و بازآموزی الگوی حرکتی بهینه در مراحل اولیه بازگشت به فعالیتهای پویا مانند دویدن است. این پدیده میتواند نشاندهنده درجه بالاتری از نوروپلاستیسیته و تطابق عصبی-عضلانی در این بازه زمانی خاص باشد. اگرچه این تغییرات از نظر آماری معنادار بودند، اما اندازه اثر محاسبهشده برای این تعاملات در بسیاری از موارد کوچک بود. این موضوع نشان میدهد الگوی تغییرات جهتدار و قابلتفسیر است، اما میزان این تغییرات از نظر بزرگی محدود میباشد و ممکن است اهمیت بالینی فوری و چشمگیری نداشته باشد. بااینحال، شناسایی همین تغییرات ظریف در مراحل اولیه بهبودی میتواند بهعنوان یک شاخص حساس از استراتژیهای جبرانی سیستم عصبی-عضلانی در نظر گرفته شود که در صورت تداوم، پتانسیل تأثیرگذاری بر مکانیک دویدن در بلندمدت را دارند.
کفی حمایتکننده قوس
تحلیل یافتهها حاکی از آن است که الگوی بهبود عصبی-عضلانی در گروههای مختلف زمانی پس از بازسازی ACL از روندهای متمایزی پیروی میکند. در بیماران با سابقه عمل کمتر از 6 ماه، بارزترین بهبود در فعالیت عضله دوسررانی طی فازهای میانه اتکا و هلدادن مشاهده گردید. این الگو منطبق را میتوان بهعنوان یک استراتژی جبرانی اولیه سیستم عصبی-عضلانی تفسیر کرد که در مراحل اولیه بازگشت به فعالیت، بر ثبات دینامیک مفصل زانو از طریق تقویت عضلات همسترینگ تأکید دارد [42]. با افزایش مدتزمان پس از جراحی، این الگو تکامل مییابد. در گروه با سابقه عمل 6-12 ماه، بیشترین بهبود در فعالیت عضله دوقلوی داخلی طی فاز کاهش شتاب ثبت شد. این تغییر، نشاندهنده تغییر تدریجی کانون توجه سیستم کنترل حرکتی از ثبات مفصل زانو به سمت بهبود کنترل نوسانات مرکز ثقل و پایداری پوسچرال در طول چرخه گامبرداری است [43].
استفاده از کفی حمایتکننده قوس به افزایش معنادار فعالیت الکتریکی عضله سرینی میانی در فاز میانه اتکا منجر شد. این عضله که اصلیترین تثبیتکننده لگن در صفحه فرونتال محسوب میشود، با ضعف خود موجب افزایش چرخش داخلی ران و استرس بر ACL میشود. کفی حمایتکننده قوس با ایجاد تکیهگاه ساختاریافته برای قوس طولی داخلی پا، سرعت و دامنه پرونیشن را در فاز میانه اتکا کاهش داده و درنتیجه زنجیره جنبشی بالاتر را تحت تأثیر قرار میدهند. این تغییرات سیستم عصبی-عضلانی را قادر میسازد تا فعالسازی عضله سرینی میانی را بهعنوان اصلیترین تثبیتکننده لگن بهینهسازی کند [44]. یافتههای کفی حمایتکننده قوس پا در مقایسه با شرایط کفی پلاسبو نیز قابلمشاهده است. در شرایط پلاسبو، اثر خستگی بر الگوی فعالیت عضله دوقلوی داخلی بهوضوح مشهود بود، درحالیکه این اثر تحت شرایط استفاده از کفی حمایتکننده قوس بهطور محسوسی تعدیل یافت. به نظر میرسد این کفیها نهتنها با کاهش بار مکانیکی مستقیم، بلکه از طریق ارائه ورودیهای حسی-عمقی بهبودیافته، هماهنگی عصبی-عضلانی را حتی در شرایط خستگی تسهیل میکنند.
کفی دبلدنسیتی
این کفی با طراحی دوگانه خود، نهتنها از قوس حمایت میکند، بلکه یک سیگنال حسی-عمقی قویتر و کنترل فعالتری روی پرونیشن ایجاد میکند. تأثیر معنادار عضلات پهن داخلی و خارجی در فاز میانه اتکا پس از خستگی نشان میدهد که با وجود حمایت کفی دبلدنسیتی، عضلات چهارسر ران همچنان تحت فشار است. این میتواند به این دلیل باشد که این کفی با بهبود راستا، اجازه میدهد فرد با کارایی بالاتری بدود و درنتیجه از عضلات چهارسر خود بیشتر استفاده کند که نهایتاً به خستگی آنها منجر میشود. این یافته احتمالاً نشاندهنده عادیسازی الگوی دویدن و فعالسازی عضلانی باشد [45]. در این راستا ارکان و همکاران، نشان دادند کفیهای اصلاحی به افزایش معنادار فعالیت الکترومیوگرافی عضلات پهن داخلی و خارجی در فاز اتکا منجر میشوند که همسو با عادیسازی الگوی عضلانی و افزایش بارکاری عضلات چهارسر ران است [46].
نتیجهگیری
بهنظر میرسد خستگی و هماستفاده از کفیهای مختلف میتوانند الگوی فعالیت عصبی-عضلانی را در افراد با بازسازی ACL و پای پرونیت تغییر دهند. در بین کفیهای موردبررسی، کفیهای تخصصیتر مانند کفی حمایتکننده قوس و کفی دبلدنسیتی پتانسیل بیشتری در تعدیل اثرات منفی خستگی و بهبود الگوی فعالیت عضلات، بهویژه در بیماران در مراحل اولیه پس از جراحی (کمتر از ۶ ماه)، نشان دادند.
از محدودیتهای پژوهش حاضر میتوان به عدم بررسی جنسیت بانوان، و عدم بررسی بلندمدت استفاده از کفی اشاره نمود. لذا پیشنهاد میشود در مطالعات آینده با در نظر گرفتن محدودیتهای این مطالعه، مطالعههایی با هدف رفع این محدودیتها انجام شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه دارای کد اخلاق به شماره (IR.UMA.REC.1404.019) از دانشگاه محقق اردبیلی و کد کارآزمایی بالینی از مرکز ثبت کارآزمایی بالینی ایران (IRCT20220129053865N2) است.
حامی مالی
این مطالعه برگرفته از رساله دکتری ابراهیم پیری از دانشگاه محقق اردبیلی میباشد و هیچگونه کمک مالی از سازمانیهای دولتی، خصوصی و غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
همه نویسندگان بهطور یکسان در مفهوم و طراحی مطالعه، جمعآوری و تجزیهوتحلیل دادهها، تفسیر نتایج و تهیه پیشنویس مقاله مشارکت داشتند.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان مطالعه حاضر از شرکتکنندگان در مطالعه حاضر سپاسگزاری میکنند.
References
- Piri E, Sobhani V, Jafarnezhadgero A, Arabzadeh E, Shamsoddini A, Zago M, et al. Effect of double-density foot orthoses on ground reaction forces and lower limb muscle activities during running in adults with and without pronated feet. BMC Sports Science, Medicine and Rehabilitation. 2025; 17(1):54. [DOI:10.1186/s13102-025-01095-5] [PMID]
- Piri E, Jafarnezhadgero A, Dehghani M, Rezazadeh F, Enteshari-Moghaddam A. [Running mechanics in individuals with anterior cruciate ligament reconstruction 6–12 months after surgery: A Systematic Review and Meta-Analysis (Persian)]. Journal of Sport Biomechanics.. 2026; 12(1):52-69. [DOI:10.61882/JSportBiomech.12.1.52]
- Jafarnezhadgero AA, Alizadeh R, Mirzanag EF, Dionisio VC. Could the anterior cruciate ligament reconstruction and pronated feet affect the plantar pressure variables and muscular activity during running? A comparative study. Journal of Bodywork and Movement Therapies. 2024; 40:986-91. [DOI:10.1016/j.jbmt.2024.07.020] [PMID]
- Grindem H, Snyder-Mackler L, Moksnes H, Engebretsen L, Risberg MA. Simple decision rules can reduce reinjury risk by 84% after ACL reconstruction: The delaware-oslo ACL cohort study. British Journal of Sports Medicine. 2016; 50(13):804-8. [DOI:10.1136/bjsports-2016-096031] [PMID]
- Dunn J, Link C, Felson D, Crincoli M, Keysor J, McKinlay J. Prevalence of foot and ankle conditions in a multiethnic community sample of older adults. American Journal of Epidemiology. 2004; 159(5):491-8. [DOI:10.1093/aje/kwh071] [PMID]
- Chen KC, Tung LC, Tung CH, Yeh CJ, Yang JF, Wang CH. An investigation of the factors affecting flatfoot in children with delayed motor development. Research in Developmental Disabilities. 2014; 35(3):639-45. [DOI:10.1016/j.ridd.2013.12.012] [PMID]
- Dolk DC, Hedevik H, Stigson H, Wretenberg P, Kvist J, Stålman A. Nationwide incidence of anterior cruciate ligament reconstruction in higher-level athletes in Sweden: A cohort study from the swedish national knee ligament registry linked to six sports organisations. British Journal of Sports Medicine. 2025; 59(7):470-9. [DOI:10.1136/bjsports-2024-108343] [PMID]
- Koreili Z, Fatahi A, Azarbayjani MA, Sharifnezhad A. [Comparison of static balance performance and plantar selected parameters in dominant and non-dominant leg active female adolescents with ankle pronation (Persian)]. The Scientific Journal of Rehabilitation Medicine. 2023; 12(2):306-19. [Link]
- Piri E, Jafarnezhadgero A, Stålman A. Advantages and disadvantages of different surgical grafts in anterior cruciate ligament injuries: A letter to the editor. Journal of Sport Biomechanics. 2024; 10(3):254-60. [DOI:10.61186/JSportBiomech.10.3.254]
- Cristiani R, Forssblad M, Edman G, Eriksson K, Stålman A. Age, time from injury to surgery and hop performance after primary ACLR affect the risk of contralateral ACLR. Knee Surgery, Sports Traumatology, Arthroscopy. 2022; 30(5):1828-35. [DOI:10.1007/s00167-021-06759-6] [PMID]
- Pfeiffer TR, Burnham JM, Hughes JD, Kanakamedala AC, Herbst E, Popchak A, et al. An increased lateral femoral condyle ratio is a risk factor for anterior cruciate ligament injury. The Journal of Bone and Joint Surgery. American volume. 2018; 100(10):857-64. [DOI:10.2106/JBJS.17.01011] [PMID]
- Ghorbanlou F, Jaafarnejad A, Fatollahi A. Effects of corrective exercise protocol utilizing a theraband on muscle activity during running in individuals with genu valgum. The Scientific Journal of Rehabilitation Medicine. 2021; 10(5):1052-65. [DOI:10.32598/SJRM.10.5.2]
- Hewett TE, Myer GD, Ford KR, Heidt Jr RS, Colosimo AJ, McLean SG, et al. Biomechanical measures of neuromuscular control and valgus loading of the knee predict anterior cruciate ligament injury risk in female athletes: A prospective study. The American Journal of Sports Medicine. 2005; 33(4):492-501. [DOI:10.1177/0363546504269591] [PMID]
- Gray EG, Basmajian JV. Electromyography and cinematography of leg and foot (“normal” and flat) during walking. The Anatomical Record. 1968; 161(1):1-15. [DOI:10.1002/ar.1091610101] [PMID]
- Lim BW, Hinman RS, Wrigley TV, Sharma L, Bennell KL. Does knee malalignment mediate the effects of quadriceps strengthening on knee adduction moment, pain, and function in medial knee osteoarthritis? A randomized controlled trial. Arthritis Care & Research: Official Journal of the American College of Rheumatology. 2008; 59(7):943-51. [DOI:10.1002/art.23823] [PMID]
- Naderi A, Baloochi R, Rostami KD, Fourchet F, Degens H. Obesity and foot muscle strength are associated with high dynamic plantar pressure during running. The Foot. 2020; 44:101683. [DOI:10.1016/j.foot.2020.101683] [PMID]
- Jaafarnejad A, Valizade-Orang A, Ghaderi K. [Comparison of muscular activities in patients with covid19 and healthy control individuals during gait (Persian)]. Scientific Journal of Rehabilitation Medicine. 2021; 10(1):168-74. [DOI:10.22037/jrm.2021.114587.2563]
- Gerlach KE, White SC, Burton HW, Dorn JM, Leddy JJ, Horvath PJ. Kinetic changes with fatigue and relationship to injury in female runners. Medicine and Science in Sports and Exercise. 2005; 37(4):657-63. [DOI:10.1249/01.MSS.0000158994.29358.71] [PMID]
- McPoil TG, Cornwall MW. The effect of foot orthoses on transverse tibial rotation during walking. Journal of the American Podiatric Medical Association. 2000; 90(1):2-11. [DOI:10.7547/87507315-90-1-2] [PMID]
- Klingman RE, Liaos SM, Hardin KM. The effect of subtalar joint posting on patellar glide position in subjects with excessive rearfoot pronation. Journal of Orthopaedic & Sports Physical Therapy. 1997; 25(3):185-91. [DOI:10.2519/jospt.1997.25.3.185] [PMID]
- Nawoczenski DA, Ludewig PM. Electromyographic effects of foot orthotics on selected lower extremity muscles during running. Archives of Physical Medicine and Rehabilitation. 1999; 80(5):540-4. [DOI:10.1016/S0003-9993(99)90196-X] [PMID]
- Hsieh RL, Peng HL, Lee WC. Short-term effects of customized arch support insoles on symptomatic flexible flatfoot in children: A randomized controlled trial. Medicine. 2018; 97(20). [DOI:10.1097/MD.0000000000010655] [PMID]
- Yip CH, Chiu TT, Poon AT. The relationship between head posture and severity and disability of patients with neck pain. Manual Therapy. 2008; 13(2):148-54. [DOI:10.1016/j.math.2006.11.002] [PMID]
- Jafarnezhadgero AA, Majlesi M, Azadian E. Gait ground reaction force characteristics in deaf and hearing children. Gait & Posture. 2017; 53:236-40. [DOI:10.1016/j.gaitpost.2017.02.006] [PMID]
- Picciano AM, Rowlands MS, Worrell T. Reliability of open and closed kinetic chain subtalar joint neutral positions and navicular drop test. Journal of Orthopaedic & Sports Physical Therapy. 1993; 18(4):553-8. [DOI:10.2519/jospt.1993.18.4.553] [PMID]
- World Medical Association. World Medical Association Declaration of Helsinki. Ethical principles for medical research involving human subjects. Bulletin of the World Health Organization. 2001;79(4):373-4. [PMID]
- McWalter EJ, Cibere J, MacIntyre NJ, Nicolaou S, Schulzer M, Wilson DR. Relationship between varus-valgus alignment and patellar kinematics in individuals with knee osteoarthritis. The Journal of Bone and Joint Surgery. American volume. 2007; 89(12):2723-31. [DOI:10.2106/JBJS.F.01016] [PMID]
- Williams DS, McClay IS. Measurements used to characterize the foot and the medial longitudinal arch: reliability and validity. Physical Therapy. 2000; 80(9):864-71. [DOI:10.1093/ptj/80.9.864]
- Valizadeorang A, Ghorbanlou F, Jafarnezhadgero A, Alipoor Sarinasilou M. [Effect of knee brace on frequency spectrum of ground reaction forces during landing from two heights of 30 and 50 cm in athletes with anterior cruciate ligament injury (Persian)]. The Scientific Journal of Rehabilitation Medicine. 2019; 8(2):159-68. [DOI:10.22037/jrm.2018.111377.1950]
- Kamonseki DH, Gonçalves GA, Yi LC, Júnior IL. Effect of stretching with and without muscle strengthening exercises for the foot and hip in patients with plantar fasciitis: A randomized controlled single-blind clinical trial. Manual Therapy. 2016; 23:76-82. [DOI:10.1016/j.math.2015.10.006] [PMID]
- Farahpour N, Jafarnezhadgero A, Allard P, Majlesi M. Muscle activity and kinetics of lower limbs during walking in pronated feet individuals with and without low back pain. Journal of Electromyography and Kinesiology. 2018; 39:35-41. [DOI:10.1016/j.jelekin.2018.01.006] [PMID]
- Cohen J. Quantitative methods in psychology: A power primer. Psychological Bulletin. 112:1155-9. [Link]
- Alizadeh R, Jafarnezhadgero AA, Khezri D, Sajedi H, Fakhri Mirzanag E. [Effect of short-term use of anti-pronation insoles on plantar pressure variables following anterior cruciate ligament reconstruction with a pronated foot during gait (Persian)]. Journal of Gorgan University of Medical Sciences. 2024; 26(3):36-44. [DOI:10.61186/goums.26.3.36]
- Jafarnezhadgero AA, Noroozi Z, Piri E. [Evaluating the frequency of the electrical activity of lower limb muscles before and after fatigue during running in individuals with a history of coronavirus disease 2019 compared to healthy individuals (Persian)]. Journal of Gorgan University of Medical Sciences. 2024; 26(1):56-65. [DOI:10.61882/goums.26.1.56]
- Koblbauer IF, van Schooten KS, Verhagen EA, van Dieën JH. Kinematic changes during running-induced fatigue and relations with core endurance in novice runners. Journal of Science and Medicine in Sport. 2014; 17(4):419-24. [DOI:10.1016/j.jsams.2013.05.013] [PMID]
- Ushiyama J, Katsu M, Masakado Y, Kimura A, Liu M, Ushiba J. Muscle fatigue-induced enhancement of corticomuscular coherence following sustained submaximal isometric contraction of the tibialis anterior muscle.Journal of Applied Physiology. 2011; 110(5):1233-40. [DOI:10.1152/japplphysiol.01194.2010] [PMID]
- Kaya Keles CS, Hiller J, Zimmer M, Ates F. In vivo tibialis anterior muscle mechanics through force estimation using ankle joint moment and shear wave elastography. Scientific Reports. 2025; 15(1):32461. [DOI:10.1038/s41598-025-18292-4] [PMID]
- Shan W, Zheng T, Zhang J, Pang R. Effect of electrical stimulation on functional recovery of lower limbs in patients after anterior cruciate ligament surgery: A systematic review and meta-analysis. BMJ Open. 2025; 15(7):e089702. [DOI:10.1136/bmjopen-2024-089702] [PMID]
- Kakehata G, Goto Y, Iso S, Kanosue K. The timing of thigh muscle activity is a factor limiting performance in the deceleration phase of the 100-m dash. Medicine & Science in Sports & Exercise. 2022; 54(6):1002-12. [DOI:10.1249/MSS.0000000000002876] [PMID]
- Pairot-de-Fontenay B, Willy RW, Elias ARC, Mizner RL, Dubé MO, Roy JS. Running biomechanics in individuals with anterior cruciate ligament reconstruction: A systematic review. Sports Medicine. 2019; 49(9):1411-24. [DOI:10.1007/s40279-019-01120-x] [PMID]
- Sahinis C, Amiridis IG, Enoka RM, Kellis E. Differences in activation amplitude between semitendinosus and biceps femoris during hamstring exercises: A systematic and critical review with meta-analysis. Journal of Sports Sciences. 2025; 43(11):1054-69. [DOI:10.1080/02640414.2025.2486879] [PMID]
- Chen B, Wu J, Jiang J, Wang G. Neuromuscular and biomechanical adaptations of the lower limbs during the pre-landing and landing phase of running under fatigue conditions. Applied Sciences. 2025; 15(5):2449. [DOI:10.3390/app15052449]
- Thorp JE, Adamczyk PG. Mechanisms of gait phase entrainment in healthy subjects during rhythmic electrical stimulation of the medial gastrocnemius. Plos One. 2020; 15(10):e0241339. [DOI:10.1371/journal.pone.0241339] [PMID]
- Meekins MM, Zucker-Levin A, Harris-Hayes M, Singhal K, Huffman K, Kasser R. The effect of chronic low back pain and lumbopelvic stabilization instructions on gluteus medius activation during sidelying hip movements. Physiotherapy Theory and Practice. 2025; 41(3):563-70. [DOI:10.1080/09593985.2024.2357130] [PMID]
- Zhang X, Ren W, Wang X, Yao J, Pu F. Quantitative analysis of quadriceps forces in adolescent females during running with infrapatellar straps. Journal of Sports Science & Medicine. 2024; 23(4):787-98. [DOI:10.52082/jssm.2024.787] [PMID]
- Erkan E, Çankaya T. Investigation of the effect of different types of insoles on electromyographic muscle activation in individuals with pes planus. Karya Journal of Health Science. 2025; 6(1):38-43. [DOI:10.52831/kjhs.1537793]
نوع مطالعه: پژوهشی |
موضوع مقاله:
اورتز و پروتز
دریافت: 1404/7/28 | پذیرش: 1404/9/21 | انتشار: 1404/10/11
دریافت: 1404/7/28 | پذیرش: 1404/9/21 | انتشار: 1404/10/11
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |